- [ 25 juillet 2024 ] Les hôpitaux publics estiment que l’instabilité politique est « dommageable » et appellent à nommer un ministre « rapidement » News
- [ 25 juillet 2024 ] Paris 2024 et Covid : Frédéric Valletoux, rassurant, suit la situation « de très près », certaines délégations déjà touchées News
- [ 25 juillet 2024 ] Le sémaglutide est-il également anti-inflammatoire ? News
- [ 25 juillet 2024 ] Retraite des HU : les décrets parus déçoivent News
- [ 24 juillet 2024 ] L’IA pour prédire la progression d’un déclin cognitif léger vers la maladie d’Alzheimer News
- [ 24 juillet 2024 ] Paris 2024 : Alerte au Covid, plusieurs athlètes belges positifs News
- [ 24 juillet 2024 ] Diabète de type 2 : les analogues du GLP-1 protecteurs face aux cancers liés à l’obésité? News
- [ 24 juillet 2024 ] Le nombre de « lapins médicaux » en baisse News

Insuffisances mitrales : prise en charge et place du traitement percutané
Coordination : Jean-François Aviérinos (Marseille)
Le Cardiologue n° 433 – Juin 2020
Dr Jean-François Aviérinos – Marseille
Rappels anatomiques [1]
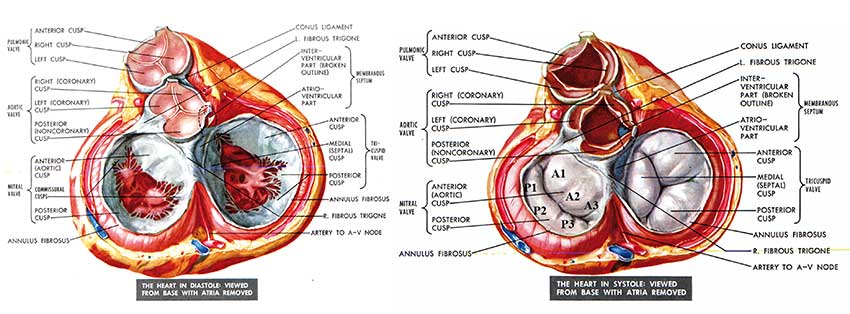
Les valves atrio-ventriculaires sont constituées d’un appareil valvulaire et d’un appareil sous valvulaire (figure 1).
• L’appareil valvulaire mitral dont la forme évoque la mitre épiscopale est considéré comme bicuspide bien qu’il soit formé en réalité de 4 feuillets. Deux d’entre eux sont aujourd’hui appelés zones commissurales, antéro-externe et postéro-interne, et divisent le voile mitral en deux feuillets principaux : un feuillet antérieur de forme grossièrement quadrangulaire et convexe en bas, anciennement appelé à tort grande valve mitrale, et un feuillet postérieur de forme rectangulaire, concave en haut, anciennement petite valve mitrale. Les deux feuillets occupent en réalité la même surface.
Figure 1. Vue postérieure de la base du cœur après résection du massif atrial, en diastole (en haut), en systole (en bas).[1]
Chacun est divisé en 3 segments de la commissure antéro externe – segment n° 1 – vers la commissure postéro interne – segment n° 3 –. L’anneau mitral sur lequel les feuillets sont sertis est constitué d’un conjonctif dense, notamment au niveau de l’espace inter trigonal tendu du trigone externe – ou gauche- au trigone interne – ou droit –, qui l’accole à la portion postérieure de l’anneau aortique réalisant une contiguïté anatomique spécifique au cœur gauche. Sa forme physiologique est elliptique vue de face et évoque une selle de cheval en vue latérale (figure 2A). Les points les plus bas ou apicaux de la selle sont les zones commissurales de l’anneau ; les points les plus hauts ou atriaux sont ses régions antérieures et postérieures. [2] Pour l’illustrer, il faut imaginer un cavalier assis sur l’anneau qui tiendrait l’aorte en guise de pommeau, jambes pendantes le long des commissures (figure 2B). La profondeur de cette selle est d’environ 10mm et la surface couverte par l’anneau mitral est comprise entre 4 et 6 cm².
Figure 2A (gauche). Forme en selle de l’anneau mitral, vue latérale gauche.
Figure 2B (droite). Forme en selle de l’anneau mitral, vue latérale postérieure.
• L’appareil sous-valvulaire mitral est constitué des 2 muscles papillaires, antéro-externe et postéro-interne, et du bouquet de cordages qui les relient aux deux hémi-valves et à la commissure homolatérales (figure 1, diastole). La bifidité des muscles papillaires est une variante anatomique fréquente, notamment au niveau du muscle papillaire postérieur. Les cordages sont classiquement de 3 ordres.
Ceux du premier ordre (cordages marginaux) s’insèrent au niveau de l’extrémité des feuillets et préviennent leur éversion systolique; ceux du second (cordages intermédiaires) s’insèrent sur la portion moyenne de la face ventriculaire des feuillets, sont moins nombreux et plus épais et participent à la rigidité de la valve en se comportant comme les baleines d’un parapluie. Ces deux premiers faisceaux naissent de l’apex des muscles papillaires.
Les cordages de 3e ordre (cordages basaux) naissent de la paroi ventriculaire près de l’orifice valvulaire et s’insèrent au niveau de la base des feuillets près de l’anneau. Ils participent au maintien de la géométrie du ventricule en préservant les rapports entre parois et squelette fibreux. La longueur moyenne des cordages est de 15 mm.
Physiologie Mitrale : rôle de l’anneau et du ventricule gauche
La continence mitrale repose sur la fine synchronisation des différents acteurs de l’étanchéité.
Dès la protosystole, le diamètre antéro-postérieur de l’anneau mitral diminue majorant sa forme elliptique et diminuant la surface à couvrir. Simultanément, sa forme en selle s’accentue par la contraction des fibres ventriculaires longitudinales médiales et latérales, exerçant une traction sur les zones commissurales de l’anneau tandis que ses points antérieurs et postérieurs restent fixes (figure 3, gauche).
Cette dynamique annulaire, de découverte récente, [3] rapproche les feuillets du plan de l’anneau qui « descend à leur rencontre » pendant que les muscles papillaires remontent dans un mouvement synchrone. Cette synergie assure l’étanchéité protosystolique, alors que les forces de poussée ventriculaire sont encore insuffisantes pour permettre l’apposition valvulaire. Le rôle de la contraction ventriculaire intervient plus tardivement, permettant de verrouiller le système dès la mésosystole, lorsque la participation de l’anneau devient négligeable.
L’étanchéité mitrale suppose donc aussi l’intégrité du ventricule gauche (VG) dont la connexion à l’appareil mitral crée une entité anatomique et fonctionnelle appelée boucle ventriculo-valvulaire [4] (figure 3, droite). Il s’agit d’une unité anatomique et fonctionnelle, musculaire et fibreuse, qui débute au niveau de l’anneau aortique antérieur par l’attache de fibres musculaires sous-épicardiques qui descendent de façon oblique vers l’apex VG en prenant une localisation sous-endocardique pour donner les muscles papillaires qui en sont une émanation. La boucle se prolonge par les cordages qui assurent la continuité avec l’appareil valvulaire et le squelette fibreux.
Figure 3. Physiologie de l’étanchéité mitrale : accentuation protosystolique de la forme en selle de l’anneau (gauche) et boucle ventriculo-valvulaire (droite). [3,4]
Le fonctionnement optimal de l’ensemble ainsi constitué suppose donc un VG de fonction systolique normale, non dilaté et dont les muscles papillaires sont intacts sur le plan anatomique et fonctionnel. Leur participation active à l’étanchéité débute en effet en protosystole par leur rapprochement l’un de l’autre qui suit la contraction annulaire et leur permet de conserver une position symétrique par rapport au centre de l’anneau afin d’éviter la déformation des feuillets. Sous l’effet de la contraction longitudinale, les muscles papillaires remontent ensuite vers l’anneau au moment de l’accentuation de sa forme en selle, avant de se raccourcir en méso et télésystole pour éviter le prolapsus valvulaire.
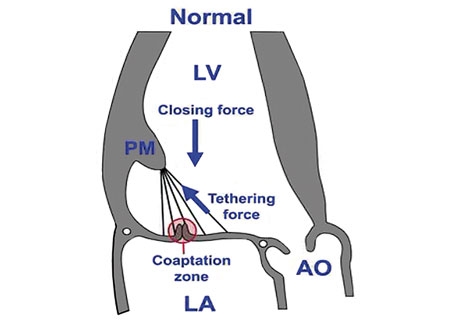
L’apposition optimale des feuillets qui en résulte se fait même dans le VG immédiatement en aval du plan de l’anneau mitral avec une hauteur de coaptation de 8 à 10mm d’une commissure à l’autre. Ce chevauchement permet de générer des forces de frottement considérables qui s’opposent à la poussée ventriculaire et auto entretiennent l’étanchéité par un phénomène de clef de voûte, les deux feuillets s’arc-boutant l’un sur l’autre (figure 4).
Figure 4. Coaptation normale des feuillets mitraux
Toute solution de continuité de la boucle mettra en péril l’harmonie du système, qu’elle soit la conséquence d’une pathologie organique mitrale, valvulaire ou sous-valvulaire, responsable d’une IM dite primaire -historiquement « organique »-, ou d’une pathologie purement ventriculaire créant une IM dite secondaire ou fonctionnelle.
Principes de correction
Une telle complexité physiologique laissait bien peu de chance de succès aux tentatives de réparation valvulaire chirurgicales. Pourtant, sous l’impulsion audacieuse et visionnaire de chirurgiens américains et français, au premier rang desquels se plaçait le Pr Carpentier, [5] le développement et l’efficacité des techniques de réparation chirurgicales des IM primaires dégénératives par prolapsus développées dès le début des années 1980 allaient devenir le support des stratégies chirurgicales précoces à l’aube des années 2000. La plastie mitrale s’adresse désormais aux lésions les plus complexes, dont seules celles avec calcifications extensives valvulaires et surtout sous valvulaires tiennent encore en échec les chirurgiens.
Depuis les premières résections quadrangulaires et les transferts de cordages, les techniques de plastie ont évolué vers l’utilisation large des cordages artificiels. La réparation bord à bord chirurgicale développée par le Pr Alfieri à la fin des années 1990, [6] bien que ne restaurant pas l’anatomie et perçue parfois comme moins élégante, offre le mérite de la simplicité et des résultats satisfaisants, notamment dans les prolapsus complexes et en cas d’exposition non optimale.
Quelle que soit la méthode, la mise en place d’un anneau synthétique, rarement péricardique, complet ou incomplet d’un trigone à l’autre, bien qu’elle ne restaure pas la dynamique annulaire, complète le geste. Les tentatives de reconstruction des IM primaires restrictives sont restées en revanche peu reproductibles et se heurtent à la rigidité des feuillets et au manque d’étoffe valvulaire. Plus encore, la problématique des IM secondaires n’a pas été résolue et les tentatives de réparation par annuloplastie isolée, en offrant une solution annulaire à une pathologie ventriculaire, se sont révélées inefficaces après deux décennies d’acharnement.
Conclusion
Devant tant de complexité physiologique et de longue réflexion chirurgicale, pouvait-il rester une place pour de simples gestes per cutanés, dont le moins que l’on puisse en dire est qu’ils ne restaurent ni l’anatomie ni la physiologie ? Gallilée aurait pu marmonner : « E pur funziona » … peut-être… Quoi que pourrait laisser penser les essais princeps néanmoins, l’expérience clinique montre que dans le cadre des IM primaires, le clip mitral percutané fait moins bien que la chirurgie en terme de réduction de la fuite et ne peut s’adresser, dans l’état actuel de la technique, qu’aux contre-indications chirurgicales chez des patients très symptomatiques et en règle générale très âgés. Dans ce cadre, une simple réduction de l’IM permet d’atténuer son retentissement fonctionnel et souvent de restaurer une qualité de vie acceptable, objectif pertinent à cet âge. De là à étendre ses indications aux patients jeunes et asymptomatiques, la route sera longue. Ses résultats dans l’IM secondaire bénéficient en revanche de l’imperfection des méthodes de plastie chirurgicale et du risque opératoire majoré par la dysfonction VG sous-jacente.
Bonne lecture.
Références bibliographiques
[1] Franck H Netter. Atlas d’anatomie humaine. Masson. Deuxième édition
[2] Robert A Levine. The relationship of mitral annular shape to the diagnosis of mitral valve prolapse. Circulation 75, 4, 756-767, 1987
[3] Y Topilsky, Real-time 3-Dimensional dynamics of functional mitral regurgitation : a prospective quantitative and mechanistic study . J Am Heart Assoc 2013 ; 2(3) e39
[4] JJ Silbiger, Novel pathogenetic mechanisms and structural adaptations in ischemic mitral regurgitation, JASE, 26(10), 1107-1117. 2013
[5] A Carpentier. Cardiac valve surgery – « The french correction »- JTCVS, 86, 323-337, 1983
[6] F Maisano. The edge-to-edge technique : a simplified method to correct mitral insufficiency. EJCTS, 13(3), 240-246. 1998
Jean-François Aviérinos. Marseille
L’insuffisance mitrale (IM), tout grade et toute étiologie confondus, est le plus fréquent des dysfonctionnements valvulaires dont la prévalence est estimée à 6 % entre 65 et 75 ans et à plus de 9 % après 75 ans [1] ; elle occupe le deuxième rang des indications chirurgicales pour valvulopathie derrière la sténose aortique. L’étiologie la plus fréquente des IM primaires en occident est le prolapsus valvulaire mitral (PVM) qui affecte 2% de la population soit 150 millions d’individus dans le monde, dont moins d’un quart développeront une IM sévère. [2] Ce sont ces fuites mitrales, dites dégénératives par PVM, le plus souvent associé à une rupture de cordage, qui depuis 25 ans ont servi de modèle à la connaissance de son histoire naturelle et à la définition des déterminants du pronostic postopératoire. [3] Malgré la somme des données colligées, ses indications chirurgicales dans certains sous-groupes font l’objet d’une controverse animée.
I. La problématique ventriculaire
L’impact pronostique défavorable d’une IM primaire semble significatif à partir des valeurs de 40mm² pour la surface de l’orifice régurgitant (SOR) et de 60ml pour le volume régurgité (VR). Ces critères modernes de sévérité, à nuancer par la nécessité d’une approche multiparamétrique lors de la quantification d’une IM, ont été définis devant l’observation d’un excès de mortalité sous traitement conservateur au-delà de ces seuils chez des patients pourtant asymptomatiques au diagnostic. L’origine de la surmortalité, avant ou malgré la correction de la fuite, semble être liée au développement d’une dysfonction systolique ventriculaire gauche (VG), conséquence de l’évolution trop longue d’une fuite trop sévère et dont les bases histologiques et moléculaires ont été précisées à partir de modèles animaux. Des modifications cellulaires altérant la myosine et la régulation intra-myocytaire du calcium s’associent à l’augmentation de l’activité protéolytique et pro-apoptotique de l’interstitium, conduisant à l’apoptose myocytaire et à l’apparition d’une fibrose initialement diffuse puis de remplacement. La question centrale de la prise en charge de ces patients est donc celle de la détection précoce des dysfonctions systoliques débutantes, dont les indices échographiques classiques peuvent être pris en défaut par les modifications des conditions de charge induites par la présence de l’IM.
II. Impact des symptômes
L’apparition de symptômes sévères de classe III ou IV au cours de l’évolution d’une IM primaire sévère chronique constitue à la fois un tournant évolutif indiscutable de la valvulopathie, [4] mais aussi un facteur de risque de complications postopératoires que la valve ait été remplacée ou réparée.
Ces symptômes traduisent vraisemblablement la présence d’une dysfonction VG sous-jacente déjà constituée et irréversible. L’interprétation des symptômes de classe II est plus délicate et leur impact a été peu étudié compte tenu de leur faible spécificité chez des patients dont l’âge moyen au diagnostic d’IM sévère se situe aux alentours de 65 ans.
III. Pertinence des indices échographiques classiques de fonction ventriculaire gauche
La diminution de la fraction d’éjection VG (FEVG) et l’augmentation du diamètre télésystolique (DTS) sont des marqueurs fiables de dysfonction VG systolique avérée comme en atteste leur impact sur la survie sous traitement conservateur. L’altération de ces indices impose à ce titre la correction rapide de la fuite mitrale.
Sont-ils pour autant des reflets fidèles d’une fonction systolique préservée tant qu’ils restent normaux ? Probablement non. En effet, la valeur seuil de FE associée à une majoration du risque d’événements sous traitement médical se situe aux alentours de 60 %, [5] seuil malheureusement corrélé aussi à une dégradation du pronostic postopératoire. [6] (figure 1). Le seuil de 64 % a même été suggéré comme facteur de risque de dysfonction VG postopératoire. [7]
Figure 1. Impact de la fraction d’éjection VG préopératoire sur la survie sous traitement conservateur (gauche) et sur le pronostic postopératoire (droite). [5,6]
Dans le seul travail consacré à ce jour à l’impact du DTS dans l’histoire naturelle de l’IM primaire, la valeur de 40 mm ou 22 mm/m², et non celle de 45 mm, était un facteur de risque indépendant d’événements cardiovasculaires sous traitement conservateur. [8] Elle était aussi associée à un pronostic postopératoire défavorable. Le seuil de 37 mm a même été cité comme facteur de risque indépendant de dysfonction VG postopératoire. [7]L’élément plus troublant encore est la haute prévalence des dysfonctions VG postopératoires « inattendues », régulièrement rapportés chez 10 % environ des patients dont les paramètres VG préopératoires étaient pourtant strictement normaux même en retenant les seuils les plus stricts. [8] Ces observations soulignent clairement le manque de sensibilité de ces deux indices dans la détection des dysfonctions systoliques VG débutantes.
IV. Fibrillation atriale (FA) et hypertension pulmonaire (HTP)
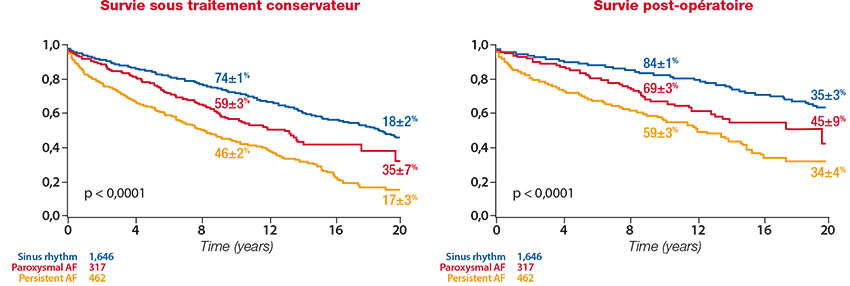
La survenue d’un premier épisode de FA dans l’histoire naturelle d’une IM primaire sévère est un facteur de risque d’événements indépendamment de toutes les autres variables. Cet aphorisme ancien a récemment été confirmé par une étude issue du registre MIDA ayant inclus plus de 2400 patients avec IM sévère par rupture de cordage mitral, dont 1600 étaient en rythme sinusal au diagnostic et près de 800 présentaient une FA paroxystique, persistante ou permanente. [9]Ce travail a souligné non seulement l’impact pronostique délétère de la FA sous traitement conservateur mais aussi la surmortalité et la majoration des événements cardiovasculaires postopératoires associées à sa présence préopératoire (figure 2). Les auteurs concluaient logiquement à la nécessité de poser l’indication chirurgicale dès le premier accès de FA mais aussi à la pertinence d’une correction plus précoce de l’IM avant toute arythmie supra-ventriculaire, laquelle posera en outre la question de l’anticoagulation postopératoire, particulièrement inopportune chez un patient dont la valve a été réparée. Le problème posé par la FA survenant chez un patient dont l’IM primaire n’est que modérée n’est pas résolu.
Les données concernant l’hypertension pulmonaire (HTP) préopératoire définie par des PAPs > 50 mmHg, bien que moins fournies, apportent des conclusions similaires, montrant son impact défavorable sur la mortalité spontanée mais aussi sur la survie postopératoire. [10]
Figure 2. Impact de la fibrillation préopératoire sur la survie sous traitement conservateur (gauche) et sur la survie postopératoire (droite). [9]
V. Plastie mitrale, condition des stratégies précoces
Pour pallier l’absence de signal chirurgical idéal, qui « donnerait le la » sans compromettre le pronostic postopératoire par sa « seule présence », les stratégies chirurgicales précoces ont eu pour objectif de soustraire au plus tôt le VG aux conséquences d’une fuite mitrale sévère, faute de savoir en déceler les dysfonctions débutantes. Encore fallait-il pour cela disposer d’un outil permettant de ne pas tomber de Charybde en Scylla. Celui-ci fut fourni par l’extraordinaire développement de la réparation valvulaire mitrale qui, sous l’impulsion notamment de l’école Française, [11] permit dès le début des années 1980 de soustraire les patients aux complications des prothèses valvulaires.
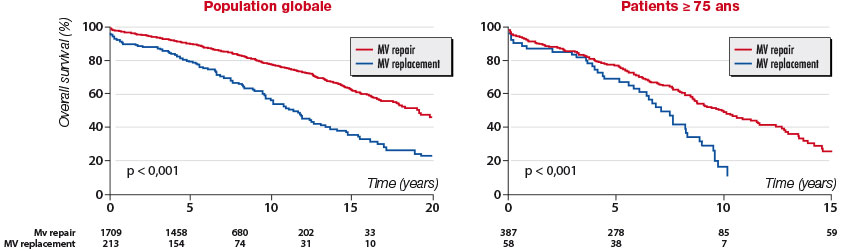
Toutes les études observationnelles ayant comparé plastie mitrale et remplacement valvulaire en termes de mortalité, d’événements cardiovasculaires et de fonction systolique ventriculaire gauche postopératoires ont rapporté l’écrasante supériorité de la réparation, à moyen terme comme à très long terme. Ce bénéfice a également été observé chez l’octogénaire, réfutant l’idée selon laquelle réparer une valve mitrale est inutile chez le sujet âgé. Ces données déjà anciennes ont récemment été confortées par un autre travail issu du registre MIDA portant sur près de 2 000 patients. [12]Cette étude a montré en outre la faible incidence de réinterventions pour récidive de fuite mitrale, estimée à moins de 10 % à 20 ans soit une incidence similaire à celle observée après implantation d’une prothèse mécanique (figure 3). Pour mémoire, ce taux est supérieur à 80 % après implantation d’une prothèse biologique.
Figure 3. Pronostic postopératoire après plastie mitrale et remplacement valvulaire mitral, dans la population globale (gauche) et chez les patients ≥ 75 ans (droite). [12]
VI. Bénéfices des stratégies précoces
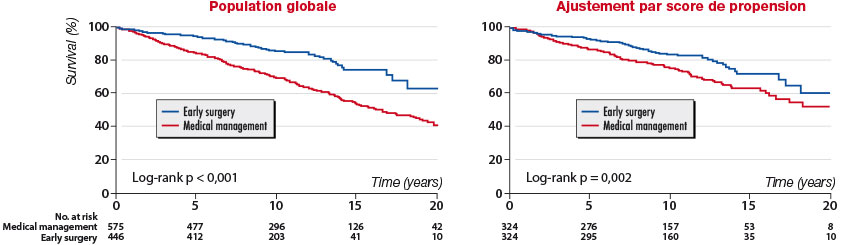
En l’absence d’essai randomisé publié à ce jour, les seules études ayant comparé l’impact d’une chirurgie précoce à celui d’une prise en charge plus conservatrice sont observationnelles et rétrospectives. Un premier travail issu de l’équipe de Bruxelles conduit chez près de 200 patients avec IM sévère sur PVM, asymptomatiques et sans indication de classe I, a comparé le pronostic postopératoire de 125 patients opérés dans les 3 mois suivant le diagnostic à celui de 67 patients ayant bénéficié d’une chirurgie plus tardive. La mortalité postopératoire globale et cardiovasculaire ainsi que l’incidence des événements non mortels étaient très supérieurs chez les patients opérés tardivement, y compris chez ceux dont le suivi avait été très rapproché. [13]Une seconde étude issue du registre MIDA ayant inclus plus de 1 000 patients avec IM sévère sur rupture de cordage, sans indication chirurgicale de classe I, a également comparé le pronostic postopératoire de 446 patients ayant bénéficié d’une chirurgie précoce dans les 3 mois suivant le diagnostic à celui de 575 patients opérés plus tard. [14] Le bénéfice de la chirurgie précoce en termes de mortalité et d’insuffisance cardiaque postopératoire était observé dans la population globale et après ajustement des groupes par score de propension (figure 4).
Suivant un protocole similaire, un dernier travail Sud-Coréen mené chez 610 patients asymptomatiques avec IM sévère sur prolapsus sans indication de classe I, a comparé le pronostic postopératoire de 225 patients opérés précocement dans les 6 mois suivant le diagnostic à celui de 375 patients opérés après ce délai. Le bénéfice de la chirurgie précoce était là encore très significatif en termes de mortalité cardiovasculaire et d’événements non fatals. [15]
Figure 4. Comparaison du pronostic postopératoire entre stratégies chirurgicales précoces (« early surgery ») et chirurgie plus tardive (« medical management »), dans la population globale (gauche) et après ajustement des groupes par score de propension (droite). [14]
VII. Concept du Watchful waiting
Du nom de l’étude éponyme publiée en 2006, [16] cette attitude consiste a contrario à attendre la survenue de signaux durs pour poser l’indication chirurgicale et nourrit avec les stratégies précoces une polémique inattendue compte tenu de la faiblesse des données. Le travail originel avait inclus 132 patients d’âge moyen 55 ans suivis pour IM sévère, dont 38 furent opérés devant des indications de classe I (symptômes, diminution de la FE, dilatation ventriculaire gauche) ou de classe IIa (FA ou HTP).
Le pronostic de l’ensemble de la population, incluant patients avec et sans correction chirurgicale, est apparu favorable et non différent de celui d’une population témoin en termes de mortalité et d’événements cardiovasculaires. Les auteurs ont conclu au caractère raisonnable d’une attitude conservatrice, dès lors qu’une surveillance régulière peut être proposée dans un centre de référence. Une extension de ce travail, publiée par la même équipe sous le label « active surveillance », [17] a rapporté le pronostic de 280 patients régulièrement suivis pour IM primaire volumineuse, dont 147 ont été opérés sur des indications de classe I ou IIa, essentiellement l’apparition de symptômes de classe III ou IV.
Le pronostic de l’ensemble de la population n’était pas différent de celui d’une population témoin mais 20 % des patients opérés ont conservé ou développé des symptômes après la chirurgie et 15 % une dysfonction systolique postopératoire. Deux tiers de ces derniers avaient pourtant une FEVG préopératoire normale.
La conclusion de ce second papier était similaire à celle du premier, à savoir que l’attente armée avant de poser l’indication de correction d’une IM sévère est une attitude efficace et sûre.
Outre son faible effectif, il est capital d’insister sur les spécificités de la population étudiée dans ces deux travaux, caractérisée par un âge moyen de près de 10 ans inférieur à celui des patients inclus dans la plupart des autres études et par des diamètres et volumes télédiastoliques VG moyens étonnamment bas , respectivement de 54 mm et 136 ml. Les données quantitatives des fuites mitrales de ces patients n’étaient pas fournies mais en considérant leur FE moyenne de 65 %, ces paramètres ventriculaires ne sont mathématiquement pas compatibles avec une IM primaire sévère définie par un volume régurgité supérieur à 60ml. Il est donc vraisemblable qu’une partie au moins du pronostic favorable observé dans ces deux travaux soit imputable au caractère modéré de la régurgitation.
VIII. Indications chirurgicales – Recommandations européennes et américaines
Les patients avec IM sévère dégénérative symptomatiques ou asymptomatiques mais fraction d’éjection (FE) < 60 % constituent logiquement des indications de classe I dans les deux textes. [18,19] Chez les patients asymptomatiques avec FE normale mais diamètre télésystolique (DTS) augmenté, l’indication chirurgicale relève aussi d’une recommandation de classe I mais avec une première nuance, la valeur seuil retenue étant de 40 mm pour les recommandations nord-américaines [19] et de 45 mm pour les recommandations européennes. [18] La survenue d’une FA ou la présence d’une HTP (PAPs > 50 mmHg au repos) sont retenues comme des indications de classe IIa par les deux textes.
En revanche, la divergence la plus flagrante concerne les patients en rythme sinusal, dont l’IM sévère reste asymptomatique, la FE normale, le diamètre télésystolique normal ou peu augmenté et les PAPs normales. Cette situation est considérée comme une indication chirurgicale raisonnable, de classe IIa, par les recommandations nord-américaines [19] à la condition que l’IM soit indiscutablement sévère et la valve jugée réparable dans un centre expert, sans aucune condition sur les paramètres ventriculaires ou atriaux.
Les recommandations européennes [18] n’autorisent la réparation chirurgicale chez ces patients qu’à la condition que le DTS ait atteint 40 mm et que soient en outre présente une rupture de cordage ou une dilatation atriale définie par un volume de l’OG ≥ 60 ml/m² (indication de classe IIa). Il apparait donc clairement que chacune des deux recommandations a choisi son camp, une attitude conservatrice pour les européennes, une stratégie de correction précoce pour les nord-américaines.
Ces dernières, pour les sceptiques, ont ajouté comme indication de classe IIa dans leur actualisation de 2017, la progression du DTS et la baisse de la FE sur plusieurs examens successifs, en direction des seuils critiques mais sans attendre de les avoir atteints. [19]La place du clip mitral percutané enfin fait l’objet d’un consensus qui le réserve aux IM primaires sévères symptomatiques en cas de contre-indication chirurgicale et d’espérance de vie non compromise à court terme (indication de classe IIb dans les deux textes).
Références bibliographiques
[1] N’Komo V, Burden of valvular heart disease, Lancet, 368, 1005-11, 2006
[2] Avierinos JF, Natural history of asymptomatic mitral valve prolapse in the community, Circulation, 106, 1355-61, 2002
[3] Ling LH, Clinical outcome of mitral regurgitation due to flail leaflet. NEJM, 335(19), 1417-23, 1996
[4] Tribouilloy C, Impact of preoperative symptoms on survival after surgical correction of organic mitral regurgitation: rationale for optimizing surgical indications. Circulation, 99(3):400-5, 1999
[5] Tribouilloy C, Mitral Regurgitation International Database (MIDA) Investigators, Long-term mortality associated with left ventricular dysfunction in mitral regurgitation due to flail leaflets: a multicenter analysis. Circ Cardiovasc Imaging. 7(2), 363-70, 2014
[6] Enriquez-Sarano M, Echocardiographic prediction of survival after surgical correction of organic mitral regurgitation. Circulation, 90(2):830-7, 1994
[7] Tribouilloy C, Predicting left ventricular dysfunction after valve repair for mitral regurgitation due to leaflet prolapse: additive value of left ventricular end-systolic dimension to ejection fraction. Eur J Echocardiogr. 12(9):702-10, 2011.
[8] Tribouilloy C, MIDA investigators. Survival implication of left ventricular end-systolic diameter in mitral regurgitation due to flail leaflets a long-term follow-up multicenter study. J Am Coll Cardiol. 54(21):1961-8, 2009
[9] Grigioni F, MIDA Investigators. Long-Term Implications of Atrial Fibrillation in Patients With Degenerative Mitral Regurgitation. J Am Coll Cardiol. 73(3):264-74, 2019
[10] Barbieri A, Mitral Regurgitation International DAtabase (MIDA) Investigators. Prognostic and therapeutic implications of pulmonary hypertension complicating degenerative mitral regurgitation due to flail leaflet: a multicenter long-term international study. Eur Heart J. 32(6):751-9, 2011
[11] A Carpentier. Cardiac valve surgery – « The french correction »- JTCVS, 86, 323-37, 1983
[12] Lazam S, MIDA (Mitral Regurgitation International Database) Investigators. Twenty-Year Outcome After Mitral Repair Versus Replacement for Severe Degenerative Mitral Regurgitation: Analysis of a Large, Prospective, Multicenter, International Registry. Circulation. 135(5):410-22, 2017
[13] Montant P, Long-term survival in asymptomatic patients with severe degenerative mitral regurgitation: a propensity score-based comparison between an early surgical strategy and a conservative treatment approach. J Thorac Cardiovasc Surg. 138(6):1339-48, 2009
[14] Suri RM, Association between early surgical intervention vs watchful waiting and outcomes for mitral regurgitation due to flail mitral valve leaflets. JAMA, 310(6):609-16, 2013
[15] Kang DH, Early surgery versus conventional treatment for asymptomatic severe mitral regurgitation: a propensity analysis. J Am Coll Cardiol. 63(22):2398-407, 2014
[16] Rosenhek R1, Outcome of watchful waiting in asymptomatic severe mitral regurgitation. Circulation. 9;113(18):2238-44, 2006
[17] Zilberszac R1, Long-Term Outcome of Active Surveillance in Severe But Asymptomatic Primary Mitral Regurgitation. JACC Cardiovasc Imaging. 11(9):1213-21, 2018
[18] Guidelines for the management of Valvular Heart Disease, ESC/EACTS, Eur H J, 2017
[19] Guideline for the management of patients with Valvular Heart Disease, ACC/AHA, Circulation, 2014 & 2017
Jean-François Aviérinos. Marseille
Les IM secondaires ou fonctionnelles sont caractérisées par la normalité de l’appareil valvulaire et sous-valvulaire mitral et sont la conséquence de la dysfonction systolique et du remodelage vg, d’origine ischémique – im secondaire ischémique – ou non – im secondaire non ischémique. Les IM fonctionnelles de la cardiomyopathie hypertrophique secondaires au SAM ou celles compliquant parfois les FA permanentes anciennes sur dilatation annulaire extrême – IM atriales – constituent des entités distinctes qui ne seront pas abordées dans ce chapitre. La prévalence des IM secondaires est variablement appréciée mais peut atteindre 2/3 des patients traités pour cardiopathie hypocinétique, [1,2] imposant leur recherche systématique au moment du diagnostic de la dysfonction systolique et tout au long de son suivi. Bien que l’étude du pronostic des fuites mitrales secondaires ait fait l’objet de nombreux travaux convergents qui tous s’accordent sur leur impact délétère, les indications de leur correction chirurgicale restent mal codifiées, faute de preuve formelle de son bénéfice pronostique.
I. Physiopathologie
Les IM fonctionnelles des cardiopathies hypocinétiques résultent d’un déséquilibre entre les forces de coaptation générées par la systole ventriculaire et les forces de traction exercées sur les feuillets, les premières étant diminuées par la dysfonction systolique et les secondes majorées par le remodelage VG. Sous l’effet de la dilatation cavitaire, le déplacement des muscles papillaires selon un axe antéro-postérieur et/ou médio-latéral est l’élément physiopathologique central qui les éloigne du plan de l’anneau et décale le point de coaptation vers la cavité ventriculaire. L’IM est d’autant plus volumineuse à FE identique que le déplacement des piliers est plus asymétrique par rapport au squelette fibreux ; en règle les IM les plus sévères sont observées lorsque l’éloignement du pilier postéro-interne est plus marqué que celui du pilier antéro-externe [3] (figure 1).
Figure 1. Mécanismes de l’IM secondaire. A gauche, sujet normal : équilibre des forces de fermeture et de traction, position symétrique des muscles papillaires, contraction annulaire mitrale et coaptation normale, légèrement en aval du plan de l’anneau. A droite, IM secondaire ischémique : remodelage VG, déplacement asymétrique des muscles papillaires, perte de la contraction systolique de l’anneau qui devient sphérique et coaptation anormalement apicale des feuillets avec aspect de tenting. [3]
L’asynchronisme de contraction des zones d’insertion des piliers contribue aussi au défaut d’étanchéité mais le rôle de leur dysfonction ischémique n’a jamais été démontré. La participation de l’anneau mitral à la physiopathologie des IM secondaires est mineure et n’intervient qu’en protosystole par perte de la forme en selle de l’anneau et de son accentuation systolique. Aussi l’expression historique « IM par dilatation annulaire » doit-elle être abandonnée dans ce cadre nosologique. L’aspect échographique est celui d’une IM restrictive avec un aspect en toile de tente des feuillets (« tenting »), lesquels restent normaux ou peu épaissis, soit un type IIIb de la classification de Carpentier. Bien que la fuite prédomine souvent sur la portion médiale de la ligne de coaptation pour les raisons précédentes, elle est en règle présente d’une commissure à l’autre, ce qui invalide sa quantification par la méthode de la zone de convergence.
II. Impact pronostique – effet du traitement de la dysfonction VG et de la coronaropathie
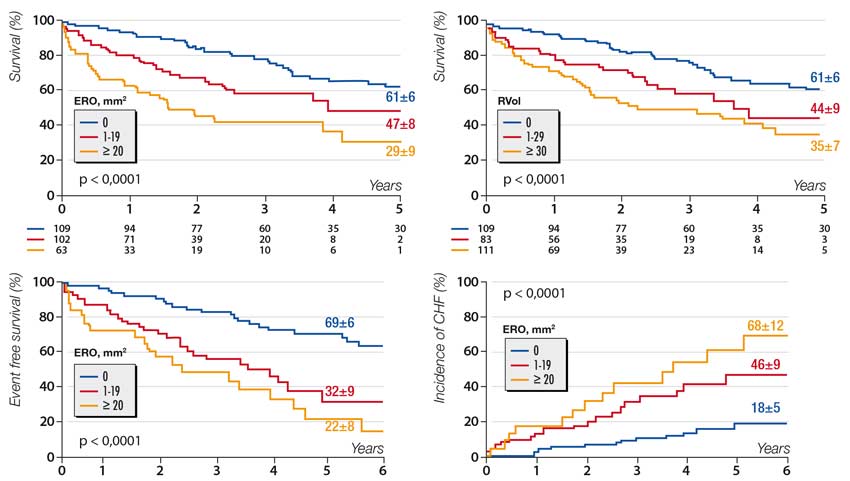
Depuis le début des années 2000, tous les travaux consacrés au sujet concluent à l’impact pronostique défavorable de l’apparition d’une IM secondaire au cours de l’évolution d’une cardiopathie hypocinétique, qu’elle soit ischémique [1] ou non, [2] ceci indépendamment des autres facteurs de risque notamment de la FE. Les valeurs de 20mm² pour la surface de l’orifice régurgitant (SOR) et de 30ml pour le volume régurgité (VR) ont été identifiées comme facteurs de risque de décès, [1] d’événements cardiovasculaires et d’insuffisance cardiaque, [4] et à ce titre furent longtemps retenues comme seuils de sévérité (figure 2).
Figure 2. Impact pronostique de l’IM secondaire ischémique sur la survie (en haut), les événements cardiovasculaires et les poussées d’insuffisance cardiaque (en bas). [1,4]
CHF : Insuffisance cardiaque ; ERO = surface de l’orifice régurgitant ; RVol = volume régurgité.
Les dernières recommandations nord-américaines actualisées en 2017 [5] ont préféré appliquer désormais aux IM secondaires les seuils de sévérité de 40 mm² pour la SOR et de 60 ml pour le VR, peut-être dans un souci d’uniformisation avec les IM primaires et vraisemblablement aussi pour que leur correction chirurgicale ne soit envisagée qu’en cas de fuite massive.
La sensibilité des IM secondaires aux modifications des conditions de charge et au remodelage VG est illustrée par leur régression parfois spectaculaire mais souvent transitoire au décours d’une poussée congestive sous l’effet d’un traitement vasodilatateur et/ou diurétique intraveineux. La diminution durable du volume régurgité peut aussi être obtenue grâce aux traitements médicamenteux de la dysfonction systolique VG et grâce à la stimulation bi-ventriculaire, en raison de l’augmentation des forces de fermeture, du remodelage ventriculaire inverse et de la resynchronisation des piliers mitraux. Ainsi, seuls les patients symptomatiques dont la fuite reste sévère malgré ce traitement optimal incluant la resynchronisation si les QRS sont larges, sont-ils des candidats chirurgicaux potentiels.
En cas d’IM ischémique et d’indication de pontage coronaire, la revascularisation isolée en revanche suffit rarement à obtenir une réduction durable de l’IM ischémique, laquelle diminue souvent en postopératoire immédiat en raison de modifications transitoires des conditions de charge induites par la CEC, avant de récidiver précocement.
La correction chirurgicale d’une fuite mitrale fonctionnelle requiert donc un geste mitral spécifique.
III. Chirurgie de l’IM secondaire : mortalité hospitalière acceptable et résultats à moyen terme décevants
Rompre le cercle vicieux né de la dysfonction systolique et entretenu par l’IM secondaire qui en aggrave l’histoire naturelle était tentant. Cette chirurgie s’est heurtée toutefois à l’imperfection des méthodes de réparation valvulaire, à leur impact pronostique incertain et au risque opératoire majoré par la dysfonction VG sous-jacente. La mortalité hospitalière reste en effet très supérieure à celle observée après chirurgie de l’IM primaire bien qu’elle ait significativement diminué dans les séries les plus récentes pour se situer actuellement entre 2 et 7 %. En l’absence de pontage coronaire associé, la mortalité opératoire n’était que de 3,3 % dans la série de la Timone ayant inclus des patients à très haut risque, avec fuite massive, en insuffisance cardiaque sous traitement médical optimal au moment de l’intervention et dont la FE moyenne était de 35 %. [6]
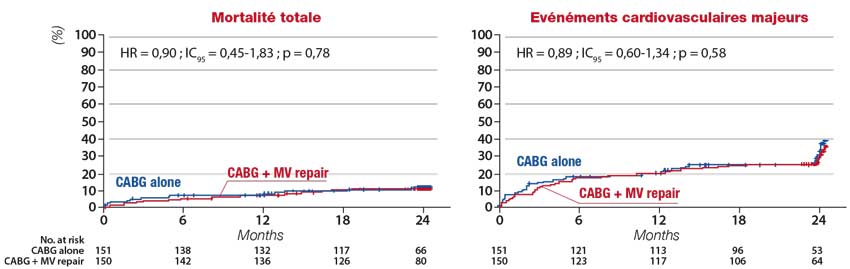
En cas d’IM ischémique et d’indication de pontage coronaire, la combinaison d’un geste mitral à la revascularisation ne semble pas augmenter significativement la mortalité opératoire, rapportée à moins de 2 % dans un essai randomisé mené chez 301 patients, d’âge moyen 65 ans, avec IM ischémique modérée à sévère (SOR moyenne = 20 mm²) et FE = 40 %, ayant comparé le pontage coronaire isolé au pontage associé à une annuloplastie restrictive. [7]
En termes pronostiques, alors que la plupart des séries observationnelles décrivent une amélioration fonctionnelle postopératoire, cet essai randomisé n’a pas montré de bénéfice du geste mitral sur les symptômes et le remodelage VG. [7,8] En outre, aucune preuve du bénéfice de la chirurgie de l’IM fonctionnelle n’a été apportée à ce jour sur les événements cliniques postopératoires, notamment dans l’essai randomisé précédent, qui rapportait de plus un temps de clampage plus long et un risque plus élevé de fibrillation atriale et d’événements ischémiques neurologiques dans le groupe pontage + annuloplastie à 1 et 2 ans. [7,8] (figure 3).
Figure 3. Absence de bénéfice pronostique de l’annuloplastie réductrice associée au pontage coronarien par rapport au pontage seul, chez 301 patients, d’âge moyen 65 ans, avec IM secondaire ischémique modérée à sévère (SOR moyenne = 20 mm²), FEVG = 40±10 % et indication de revascularisation. Essai randomisé. [8]
De même, les rares séries ayant comparé le traitement médical optimal seul à son association à la correction chirurgicale de l’IM, sont observationnelles et n’ont pas montré de supériorité de l’annuloplastie réductrice. [9] Les deux seuls essais randomisés conduits à ce jour pour évaluer l’intérêt de l’association au traitement médical d’une correction de l’IM secondaire l’ont été avec le clip mitral percutané.Ces deux études en apparence contradictoires auront eu le mérite de préciser la place du Mitraclip dans le traitement des IM secondaires, mais au-delà, celui d’apporter des éléments de réponse à la question de la pertinence du traitement de l’IM secondaire dans l’évolution d’une cardiopathie hypocinétique. Ils sont aussi à l’origine du concept d’IM disproportionnée et seront détaillés dans l’article suivant.
Enfin et pour conclure ce chapitre par une note optimiste, contrairement à la crainte théorique d’un effet soupape des IM fonctionnelles, la FE ne s’effondre pas après leur correction chirurgicale, y compris chez les patients les plus graves. [6]
IV. Chirurgie de l’IM secondaire : interpérations et perspectives
La première interprétation de ces résultats décevants est d’ordre conceptuel, car si l’IM secondaire aggrave le pronostic de la cardiopathie qui l’a créée, en faire une cible thérapeutique ne traite pas la dysfonction VG préexistante. A ce propos, une méta analyse regroupant plus de 50 études et près de 50 000 patients avec cardiopathie ischémique et non ischémique a confirmé le rôle pronostique indépendant de la présence d’une IM secondaire en termes de mortalité, d’insuffisance cardiaque et de recours à une transplantation, qu’elle soit d’origine ischémique ou non, en notant que même les IM secondaires non sévères avaient un impact pronostique défavorable. Les auteurs remarquaient « avec un soupçon de réserve toutefois » que dans la plupart de ces séries la sévérité de l’IM était corrélée à la sévérité de la dysfonction systolique et qu’il n’était pas possible d’exclure qu’elle ne soit qu’un marqueur de risque plus qu’une cause totalement indépendante de mortalité. [10]
La seconde est d’ordre technique, liée à la méthode de correction historique par annuloplastie réductrice qui nie la physiopathologie des IM secondaires en proposant une solution annulaire à un problème ventriculaire. Elle s’accompagne d’ailleurs d’une incidence élevée de fuite mitrale résiduelle ou récidivante, qui augmente avec le temps atteignant 1/3 des patients à un an dans un autre essai randomisé récent. [11]
Ce dernier, conduit chez 251 patients, d’âge moyen 68 ans, dont l’IM secondaire ischémique était très sévère (SOR moyenne = 41 mm²) et la FE = 40 %, a comparé en effet le remplacement valvulaire mitral avec préservation de l’appareil sous-valvulaire (« insertion » prothétique) à l’annuloplastie restrictive avec plus de 2/3 de pontages coronaires associés dans chaque groupe. Aucune différence n’a été observée en termes de mortalité opératoire, de mortalité totale et de survenue d’un critère composite associant mortalité, insuffisance cardiaque, accident vasculaire cérébral et nouvelle chirurgie mitrale, à 1 et 2 ans. [11,12] (figure 4). En revanche, près de 60 % des patients du groupe annuloplastie présentait une récidive de fuite mitrale au moins modérée à 2 ans contre moins de 4 % dans le groupe remplacement valvulaire. Logiquement, l’amélioration fonctionnelle, significative dans les deux groupes, était plus nette à 2 ans dans le groupe remplacement valvulaire et l’incidence de survenue d’une poussée d’insuffisance cardiaque plus faible.
Figure 4. Absence de bénéfice pronostique de l’annuloplastie réductrice sur le remplacement valvulaire mitral chez 251 patients, d’âge moyen 68 ans, avec IM secondaire ischémique sévère (SOR moyenne = 41 mm²) et FE = 40 %. Essai randomisé. [12]
Ainsi, l’insertion d’une prothèse valvulaire en conservant l’appareil sous-valvulaire peut-elle apparaître comme un moyen techniquement simple de supprimer l’IM et d’améliorer le retentissement fonctionnel de la cardiopathie, sans exposer les patients au risque de récidive de la fuite, rédhibitoire après annuloplastie isolée.
Pour pallier l’inefficacité de cette dernière, de nombreuses autres techniques de plastie chirurgicale qui intègrent plus ou moins la physiopathologie des IM secondaires, font l’objet de petites séries voire de cas cliniques. Aucune à ce jour n’a fait la preuve de sa reproductibilité et de son intérêt pronostique. Parmi elles, la technique de suture bord à bord – edge to edge – ou point d’Alfieri du nom du célèbre chirurgien milanais qui l’a promue initialement dans le PVM, consiste à suturer l’un à l’autre les feuillets mitraux par leur bord libre créant ainsi un orifice mitral double. Le point est placé au niveau de l’origine de la régurgitation ce qui, en matière d’IM fonctionnelle, se heurte au problème pratique de la fréquence des jets multiples voire à celui de la présence d’une fuite continue d’une commissure à l’autre. La preuve d’un impact bénéfique en termes pronostiques n’a pas été apportée mais ce concept de plastie mitrale a servi de modèle à la technique percutanée du Mitraclip.
Enfin, la dernière explication à ces résultats inconstants, est peut-être celle du bon sens voulant que tout soit affaire de sélection des bons patients pour la bonne technique. De façon simplifiée, les IM les plus volumineuses, symptomatiques et résistant au traitement médical, associées aux dysfonctions VG modérées sont peut-être les indications les plus raisonnables de remplacement valvulaire, qui peut-être un jour dans ce sous-groupe apportera la preuve de son intérêt pronostique. S’il en reste une encore, la place de l’annuloplastie restrictive semble se limiter, du bout des lèvres, aux IM secondaires sévères et symptomatiques avec faible déformation valvulaire, correspondant en pratique aux tenting asymétriques générées par les séquelles de nécrose inférieure limitée.
V. Conclusion – Indications chirurgicales
La prudence est la règle, aussi bien dans les recommandations américaines [5] qu’européennes [13] qui, à la différence de l’IM primaire, s’accordent sur des indications timides en matière de correction chirurgicale des IM secondaires faute de preuve formelle à ce jour de son bénéfice pronostique.
En cas d’IM secondaire ischémique avec FE peu diminuée (> 30 %), le geste mitral est indiqué en cas d’indication de pontage coronarien et d’IM sévère eu égard à l’insuffisance de la revascularisation seule à supprimer la fuite mitrale (indication de classe I en Europe, IIa aux USA). L’insertion d’une prothèse valvulaire est préférée à la réalisation d’une annuloplastie aux Etats-Unis (recommandation de classe IIa). Si la fuite n’est que modérée, les dernières recommandations européennes ne statuent plus alors qu’il s’agissait d’une indication de classe IIa en 2012 ; les recommandations américaines concèdent une indication de classe IIb. En l’absence d’indication de pontage ou en cas de cardiopathie non ischémique, la correction chirurgicale d’une IM secondaire sévère, symptomatique sous traitement médical optimal peut s’envisager pour améliorer les symptômes (recommandation de classe IIb). Le clip mitral obtient aussi une indication de classe IIb en Europe dans cette situation.
En cas de dysfonction systolique profonde (FEVG < 30 %), la correction chirurgicale de l’IM relève d’une indication de classe IIa en Europe, uniquement s’il existe une possibilité de revascularisation et une viabilité documentée. Dans le cas contraire, chirurgie et clip mitral se partagent une indication de classe IIb à mettre en balance avec la transplantation et l’assistance. Cette situation n’est abordée formellement par les recommandations américaines.
En guise de conclusion, malgré ces incertitudes, et tout ne pouvant être balayé par deux essais randomisés, la haute prévalence des IM secondaires, leur impact pronostic défavorable indiscutable et l’amélioration fonctionnelle régulièrement rapportée par les études observationnelles après leur correction, imposent leur recherche systématique chez tout patient suivi pour cardiopathie hypocinétique. Et pour le formuler différemment, l’absence de preuve définitive quant à la futilité de leur correction, imposent aussi une discussion de l’ensemble de l’équipe médico-chirurgicale autour de ces dossiers, dès que l’IM devient sévère et le patient réfractaire au traitement médical avant que la dysfonction systolique ne soit rédhibitoire.
Références bibliographiques
[1] Grigioni F, Ischemic mitral regurgitation : long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation, 103, 1759-1764, 2001
[2] Rossi A, Independent pronostic value of functionnal mitral regurgitation in patients with heart failure. Heart, 1136, 2011
[3] Y Topilsky, Real-time 3-Dimensional dynamics of functional mitral regurgitation : a prospective quantitative and mechanistic study . J Am Heart Assoc 2013 ; 2(3) e39
[4] Grigioni F, Contribution of ischemic mitral regurgitation to congestive heart failure after myocardial infarction. Journal of the American College of Cardiology, 260-267, 2005
[5] Guidelines for the management of patients with Valvular Heart Disease, ACC/AHA, Circulation, 2014 & 2017
[6] Théron, Long-term results of surgical treatment of secondary severe mitral regurgitation in patients with end-stage heart failure: advantage of prosthesis insertion. Archives of Cardio-vascular disease, 112, 95-103, 2019
[7] Smith PK, Surgical Treatment of Moderate Ischemic Mitral Regurgitation. N Engl J Med.;371(23):2178-2188, 2014
[8] Michler RE, Two-Year Outcomes of Surgical Treatment of Moderate Ischemic Mitral Regurgitation. N Engl J Med. 374(20):1932-1941, 2016
[9] Wu AH, Impact of mitral valve annuloplasty on mortality risk in patients with mitral regurgitation and left ventricular systolic dysfunction. J Am Coll Cardiol. 45(3):381-387, 2005
[10] Sannino A, Survival and cardio-vascular outcomes of patients with secondary mitral regurgitation: a systematic review and meta-analysis, JAMA Cardiol, 2(10), 1130-1139, 2017
[11] Acker MA, Mitral-Valve Repair versus Replacement for Severe Ischemic Mitral Regurgitation. N Engl J Med. 370(1):23-32, 2014
[12] Goldstein D, Two-Year Outcomes of Surgical Treatment of Severe Ischemic Mitral Regurgitation. N Engl J Med. 374(4):344-353, 2016
[13] Guidelines for the management of Valvular Heart Disease, ESC/EACTS, Eur H J, 2017
Guillaume Bonnet. Marseille
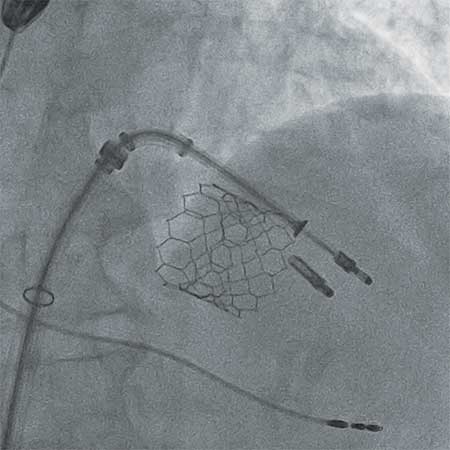
L’insuffisance mitrale est l’une des valvulopathies les plus répandues dans les populations occidentales, avec une prévalence pouvant atteindre 10 % au-delà de 75 ans. [1] Le pronostic des régurgitations sévères est péjoratif en l’absence de traitement [2] qui consiste le plus souvent, dans ses formes dégénératives du moins, en une chirurgie de réparation ou de remplacement valvulaire. La constatation qu’une proportion significative de patients n’avait pas accès à une telle prise en charge, [3,4] en raison précisément de leur âge et des comorbidités qui lui sont associées, parallèlement au désir constant d’élaborer des techniques moins invasives afin d’en faire bénéficier un plus grand nombre, ont permis l’expansion des interventions par abord percutané à cœur battant. Si l’implantation percutanée de prothèses en position mitrale (Transcatheter Mitral Valve Implantation, TMVI) est encore limitée, dans la plupart des centres, aux cas de dégénérescence de bioprothèse, la réparation valvulaire mitrale percutanée (Transcatheter Mitral Valve Repair, TMVR) est, elle, pratiquée depuis plusieurs années avec le dispositif MitraClipTM, seul validé jusqu’à présent par la Haute Autorité de Santé dans ce champ d’interventions.
I. Rationnel et expériences préliminaires
La réparation valvulaire mitrale a démontré une meilleure efficacité à long terme comparativement au remplacement prothétique et doit être privilégiée dans le traitement de l’IM. [5] Pour en permettre l’application dans des situations anatomiques défavorables (calcifications et fibrose des feuillets, calcifications annulaires compromettant une annuloplastie, …), diverses techniques chirurgicales ont été mises au point, dont celle dite de suture bord à bord décrite par le Pr Alfieri. [6] Utilisée pour la première fois en 1991, celle-ci consiste en une suture des bords libres des feuillets antérieur et postérieur, le plus souvent en leur centre (A2-P2), scindant l’orifice mitral en deux. Le maintien des feuillets par les points de suture force la coaptation en un segment, permettant celle des segments adjacents, sans compromettre la fonction et l’architecture de l’appareil sous-valvulaire et de l’anneau.
Plusieurs points sont à relever à propos de l’expérience italienne rapportée. Une annuloplastie était associée dans 80 % des cas (non réalisée en l’absence de dilatation annulaire et en cas de calcifications annulaires sévères) mais l’étude d’un sous-groupe de patients sélectionnés ayant bénéficié de la suture isolément a démontré une durabilité jusqu’à 12 ans de la correction de la fuite. [7] Dans moins de 20 % des cas une technique supplémentaire était requise pour parfaire la correction de l’IM (résections de feuillets, implantation de néocordages, …). La réduction attendue de l’orifice mitral (rapportée de 9 à 3,5 cm2 en moyenne, acceptée jusqu’à 2,5 cm2) ne se traduisait pas par une sténose valvulaire fonctionnelle, au repos comme à l’effort. [8]
De manière intéressante également, cette technique, considérée par son concepteur comme « une solution simple à des problèmes complexes », était retenue de préférence pour les lésions complexes (prolapsus des deux feuillets, du feuillet antérieur, du feuillet postérieur avec calcifications annulaires sévères, prolapsus des segments P1 et P3), mais aussi à des cas de régurgitations fonctionnelles. [9] Dans la série publiée, une amélioration fonctionnelle notable était rapportée, sans nécessité de réopération dans 95 % des cas à 6 ans. [10]
Le succès de cette technique a incité au développement d’une imitation percutanée dont le premier modèle (Evalve Clip) fut expérimenté chez le cochon et démontra sa faisabilité à cœur battant. [11]
Ce clip, composé IRM-compatible d’un alliage en cobalt-chrome recouvert de polyester, comporte deux bras sur lesquels se posent les feuillets mitraux en diastole, et de deux grippers qui, abaissés sur ces feuillets, vont permettre de les tenir en pince (grasping) ; la fermeture du clip les rapprochant en rétablissant une coaptation.
Une première implantation chez l’homme se déroula au Venezuela en 2003, dans un cas de prolapsus du feuillet antérieur, avant que l’étude de phase 1 EVEREST confirme la sécurité d’emploi, [12] et que le marquage CE soit obtenu en 2008.
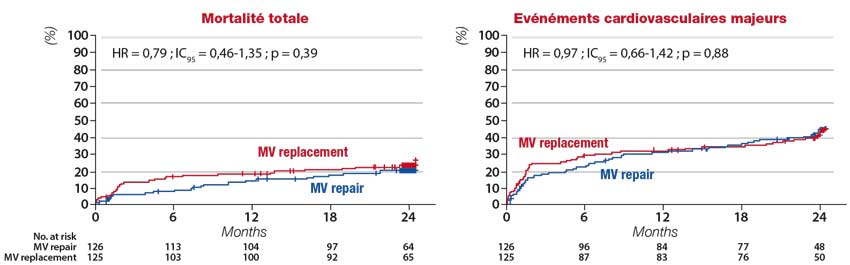
L’année 2011 vit la parution d’EVEREST II, premier essai prospectif randomisé comparant le dispositif MitraClip (acquis dans l’intervalle par la société Abbott) à la chirurgie valvulaire mitrale. [13] Parmi 279 patients âgés en moyenne de 66 ans, présentant une insuffisance mitrale au moins modérée à sévère (correspondant à un grade 3+ ou 4+ suivant les seuils recommandés alors par l’ACC/AHA), organique dans 73 % des cas, 184 étaient assignés à une réparation percutanée et 95 à une chirurgie de réparation ou de remplacement valvulaire mitral.
Cet essai conclut à une moindre efficacité du MitraClip (55 % de survenue à 1 an du critère de jugement principal associant survie, absence de réintervention et de fuite résiduelle ou récidivante d’au moins un grade 3+ vs 73 % dans le bras chirurgical), expliquée par une nécessité de ré intervention chirurgicale significativement plus élevée (20 % vs 2,2 %), tandis que la mortalité (6 %) et, de manière surprenante, le taux de fuites de grade au moins 3+ (21 % vs 20 %), étaient similaires dans les deux bras.
Avec les limites d’une analyse en sous-groupes non pré-spécifiés, le dispositif MitraClip se rapprochait significativement de l’efficacité de la chirurgie chez les patients âgés de plus de 70 ans et ceux présentant une IM secondaire (figure 1). Par ailleurs, l’analyse des cas particuliers d’implantation de clip non efficace montre la faisabilité d’une réparation chirurgicale une fois sur deux, et la possibilité d’implantation de clip supplémentaire lors d’une seconde procédure permettant d’obtenir une meilleure correction de la fuite. Dans les deux groupes était par ailleurs noté un remodelage inverse ventriculaire gauche, une amélioration fonctionnelle en classe NYHA et de la qualité de vie à 1 an.
Figure 1. Analyse du critère de jugement principal (survie, non nécessité de chirurgie valvulaire, IM résiduelle < grade 3+) dans les bras chirurgie et MitraClip dans l’ensemble de la cohorte randomisée d’EVEREST II et en sous-groupes.
En matière de sûreté, le MitraClip s’avérait supérieur à la chirurgie (15 % d’événements indésirables vs 48 % dans le bras chirurgical), sans significativité statistique toutefois après non prise en compte des transfusions. Cette étude doit être analysée en gardant à l’esprit qu’il s’agissait de confronter, il y a plus de 10 ans, un dispositif de première génération entre les mains d’opérateurs inexpérimentés à tout type de chirurgie valvulaire mitrale rodée, avec possibilité de conversion immédiate d’un échec de plastie en remplacement (14 % d’implantation de prothèses dans le bras chirurgie pour des cas pourtant accessibles à priori à une réparation).
Ces résultats, complétés par les données issues de registres incluant des patients à haut risque chirurgical, [14] ont permis néanmoins d’introduire l’année suivante dans les recommandations de l’ESC cette option thérapeutique, jugée relativement sûre, chez des patients symptomatiques, inopérables ou à haut risque chirurgical, répondant aux critères d’éligibilité échographiques d’EVEREST, estimant le taux de succès (défini comme l’obtention d’une fuite résiduelle tout au plus de grade 2+) à 75 %. [15]
II. Positionnement dans l’IM primaire
Par analogie avec son modèle chirurgical, l’IM dégénérative (prolapsus par rupture de cordage surtout) était initialement la cible de prédilection du MitraClip, et les patients à haut risque chirurgical ou inopérables, sa population d’intérêt, suivant les conclusions d’EVEREST II. Parmi les critères de haut risque, l’âge avancé est reconnu comme associé à une surmortalité et à un taux plus élevé de complications chirurgicales. [16] Dans une série de plus de 30 000 patients du Society of Thoracic Surgeons (STS) National Cardiac Registry opérés dans les années 2000, la mortalité opératoire et le taux de complications majeures étaient respectivement de 17 et 35,5 % au-delà de 80 ans contre 4,1 et 13,5 % avant 50 ans. [17] Il était logique de considérer cette population âgée comme pouvant bénéficier d’un traitement percutané qui, bien que moins efficace que la chirurgie en matière de réduction de la fuite mitrale, permettrait une amélioration symptomatique et de la qualité de vie, et peut-être retarderait le décès, au prix d’une intervention le plus souvent bien tolérée. Encore fallait-il le démontrer alors que les patients inclus dans EVEREST II, dont seulement 30 % avaient plus de 75 ans, étaient à faible risque opératoire. C’est ce que firent plusieurs registres.
À commencer par les études prospectives issues d’EVEREST II : EVEREST II High-Risk Registry et EVEREST II REALISM HR, [18] dont les analyses combinées d’une cohorte totale de 351 patients montrèrent que chez les 105 avec IM primaire sévère, d’âge moyen 82 ans, à risque de mortalité opératoire estimé par le score STS ≥ 12 %, la persistance d’une fuite résiduelle significative n’excédait pas 15 % à 1 an, ce qui se traduisait par une amélioration de la classe NYHA (I ou II dans 87 % des cas) et par un moindre taux d’hospitalisations pour insuffisance cardiaque.
Les conclusions étaient assez comparables avec les données « de vie réelle » du registre européen ACCESS-EU publiées la même année. [19] Parmi les 567 patients inclus de manière prospective entre 2009 et 2011, 117 âgés en moyenne de 76 ans présentaient une IM primaire, de grade 3+ ou 4+ dans 97 % des cas, étaient en classe NYHA III ou IV dans 73 % des cas et considérés à haut risque pour 33 d’entre eux. Chez près de 90 % de ces patients une fuite résiduelle ≤ grade 2+ était rapportée en fin d’hospitalisation. Les taux de complications et de mortalité à 1 mois étaient respectivement de 9 et 6 %. Ce taux de mortalité à 1 mois comparable dans ces deux études et rapporté ailleurs, [20] reste toutefois inférieur à celui prédit en pré-opératoire par les différents scores chirurgicaux (STS, Euroscore) et alerte sur le risque de futilité d’une intervention chez des patients présentant de trop nombreuses comorbidités ou bien une IM massive pour laquelle une diminution significative du volume régurgité n’est pas atteignable avec cette technique.
La crainte qu’une intervention percutanée soit proposée par excès à des patients très âgés et comorbides chez qui la raison recommanderait la prescription d’un diurétique seul, n’est le plus souvent pas fondée si l’on en croit les données de registres plus récents et de plus grands effectifs. Celles-ci témoignent également de la meilleure maîtrise technique de la procédure et du matériel acquise au fil du temps, 10 ans après l’inclusion des patients dans EVEREST II.
En particulier, une analyse des données portant sur les 12 334 procédures pratiquées aux États-Unis entre 2013 et 2017, incluses dans le registre nord-américain Transcatheter Valve Therapy, distinguant des tertiles d’expérience croissante du dispositif MitraClip (1-18, 19-51 et 52-482 procédures), a été publiée en 2019. [21] Les patients, âgés en moyenne de 81 ans, présentaient une IM primaire dans 87 % des cas et un score de risque STS-PROM moyen de 5,9 % pour une réparation et 8,3 % pour un remplacement.
Suivant les critères internationaux MVARC (Mitral Valve Academic Research Consortium), [22] un résultat « acceptable », défini par l’obtention d’une fuite résiduelle de grade ≤ 2 et correspondant à un succès de la procédure, était décrit dans 92 % des cas globaux, et jusqu’à 96 % dans les centres avec 200 procédures à leur actif. L’influence de l’expérience était plus marquée encore pour l’obtention d’un résultat « optimal », c’est-à-dire d’une fuite résiduelle de grade ≤ 1, significativement plus élevée dans le tertile de plus grande expérience atteignant 73 % (vs 62 % dans le tertile de début d’expérience).
Par ailleurs, l’expérience acquise après 50 procédures s’accompagnait logiquement d’un taux de complications significativement plus bas (11,5 vs 13,6 %), dominé par le recours à la transfusion (71,8 % de l’ensemble des complications dans l’effectif global), et d’un raccourcissement significatif du temps de procédure, délai entre l’entrée et la sortie du bloc opératoire (94 vs 139 min), et ce malgré l’implantation significativement plus fréquente d’au moins deux clips (46 % vs 38,5 %).
De manière intéressante, ce registre renseigne également sur les indications échographiques, ne répondant pas souvent aux critères d’EVEREST II sur lesquels nous reviendrons, à savoir que des clips étaient implantés en A1-P1 et A3-P3 dans respectivement 9 et 11 % des cas, sans information plus détaillée notamment sur la largeur du prolapsus ou la présence de calcifications.
Certaines de ces données sont postérieures à l’édition des recommandations européennes de 2017 qui demeurent inchangées depuis 2012. Elles laissent entrevoir la possibilité d’étendre les indications à des patients âgés non strictement contre-indiqués à une chirurgie, à condition de viser un résultat optimal.
Par ailleurs, le rapport de certaines études informant que la moitié des patients âgés de plus de 65 ans adressés pour une chirurgie élective ne bénéficient pas d’une réparation mais d’un remplacement valvulaire, [23] qui les expose à des risques d’endocardite, d’hémolyse sur fuite para-prothétique, d’accident thrombo-embolique ou au contraire hémorragique en lien avec l’anticoagulation en cas de prothèse mécanique, soulève le débat de l’intérêt d’une intervention percutanée, bien mieux tolérée, éventuellement à visée de retarder l’échéance d’une chirurgie.
Des études randomisées comparatives à la chirurgie ciblant une population à risque élevé ou intermédiaire, sont au préalable nécessaires pour affiner la sélection des patients pouvant tirer profit d’une réparation percutanée. Deux sont en cours à cet effet, l’une française, MITRA.HR, initiée en 2018, et l’autre nord-américaine et européenne, REPAIR MR, annoncée en début d’année. En France, la Haute Autorité de Santé retient comme indications les IM dégénératives sévères, symptomatiques malgré traitement médical optimal, chez des patients avec espérance de vie supérieure à un an, non éligibles à une chirurgie après validation par une équipe multidisciplinaire, et répondant aux critères échographiques d’éligibilité.
III. Positionnement dans l’IM secondaire
La place du dispositif MitraClip dans le traitement de l’IM secondaire est moins intuitive pour deux raisons principales : l’une physiopathologique, la régurgitation n’étant pas causée par une anomalie valvulaire mais le plus souvent par une dysfonction, régionale ou globale, du ventricule gauche, parfois par dilatation annulaire accompagnant une dilatation atriale gauche ; l’autre par absence de démonstration formelle qu’une chirurgie valvulaire mitrale améliorait la survie chez ces patients. [24] Plusieurs éléments plaident cependant pour l’emploi de cette technique chez des patients sélectionnés.
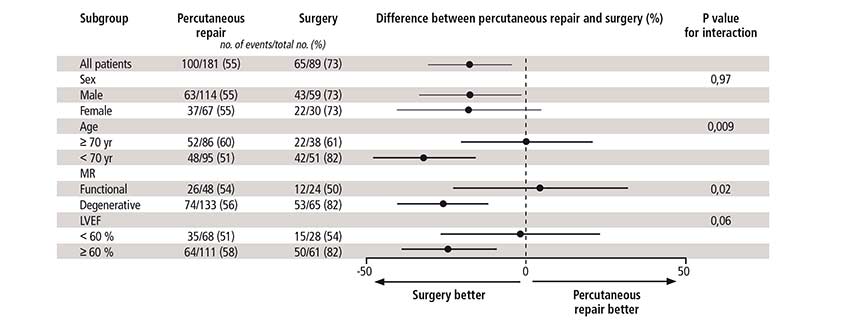
Les IM secondaires représentaient une minorité (27 %) des cas inclus dans EVEREST II, mais ce sous-groupe de patients semblant tirer un meilleur profit du MitraClip que ceux avec IM primaire, les études qui suivirent s’y intéressèrent préférentiellement.
Les 616 patients d’âge moyen 73 ans enrôlés dans le programme EVEREST II (comprenant l’essai randomisé, le registre High Risk et le registre continu REALISM), présentant une IM secondaire traitée par MitraClip entre 2005 et 2013, ont fait l’objet d’une analyse particulière. [25] D’âge moyen 73 ans, ces patients avaient un antécédent d’infarctus du myocarde dans 56 % des cas, une FEVG moyenne de 43 % et leur score de risque STS moyen était de 10 %. Un seul clip était implanté dans la majorité des cas (58 %), tandis que 3 l’étaient chez seulement 0,3 % des patients.
Malgré ce, une fuite résiduelle d’un grade 2+ ou moins, confirmée par une lecture de l’échographie dans un laboratoire indépendant, était obtenue dans 89 % des cas à la sortie. Un an après l’intervention, 77 % des patients étaient en vie, avec une fuite résiduelle ≤grade 2+ et en classe NYHA I ou II pour 85 % et 83 % d’entre eux respectivement.
L’une des explications possibles de l’amélioration échographique et symptomatique au sein d’une cohorte observationnelle est l’optimisation parallèle du traitement médical de l’insuffisance cardiaque, dont l’efficacité a été démontrée dans l’IM secondaire. [26] C’est l’une des critiques formulées à l’encontre de l’étude française MITRA-FR, premier essai randomisé ayant évalué dans l’IM secondaire le bénéfice d’une intervention par MitraClip en sus du traitement médical optimal chez des patients en classe NYHA au moins II et de FEVG entre 15 et 40 %. [27]
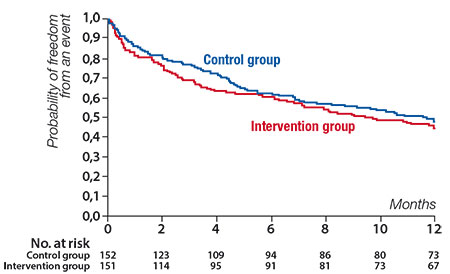
Une amélioration symptomatique similaire était en effet constatée un an après l’intervention dans chacun des deux bras de 152 patients, de même qu’aucune différence significative n’était retrouvée en matière de mortalité et d’hospitalisation pour insuffisance cardiaque à ce terme (55 % après MitraClip vs 51 % sous traitement médical seul), malgré une réduction significative de la fuite mitrale dans le bras interventionnel (grade 2+ ou moins dans 91 % des cas à la sortie d’hospitalisation) (figure 2).
Figure 2. Survie à 1 an dans l’étude Mitra-Fr.
Une autre interprétation des résultats relie cette absence de bénéfice démontré à un stade trop avancé de la maladie ventriculaire, le plus souvent ischémique, et à la sélection d’une proportion d’IM pas assez sévères. L’analyse des paramètres échographiques révèle notamment des VG sévèrement dilatés (VTD 135 mL/m2 et DTD 69 mm en moyenne), pour une FE moyenne de 33 %, ainsi que des PAP systoliques élevées (54 mmHg en moyenne), paramètre associé, au-delà de 50 mmHg, à un excès de mortalité dans l’IM secondaire. [28]
La notion de seuil de sévérité de l’IM retenu dans MITRA-FR a été largement commentée. Elle se basait notamment, suivant les recommandations européennes alors en vigueur, sur une surface d’orifice régurgitant (SOR) de plus de 20 mm2, corrélée à un pronostic péjoratif depuis les travaux de la Mayo Clinic, tandis que la valeur de 40 mm2 est retenue aux États-Unis. [29] Avec une SOR moyenne de 31 mm2, 52 % des patients inclus dans MITRA-FR, de SOR entre 20 et 30 mm2, présentaient une IM modérée suivant les critères nord-américains.
Ce sont ces critères qui furent adoptés dans l’essai randomisé COAPT publié la même année. [30] Au terme d’une sélection plus élective (61 % des patients éligibles non randomisés vs 32 % dans MITRA-FR), le double d’effectif (614 patients) était enrôlé, d’âge moyen (72 ans) et de FEVG (31 %) du même ordre, mais de dimensions ventriculaires gauches moins péjoratives (DTD 62 mm vs 69 mm dans MITRA-FR, tandis que les VTD, de 101 mL/m2 en moyenne, étaient probablement sous-estimés) [31], et de sévérité de l’IM plus importante si l’on en juge par la SOR moyenne de 41 mm2.
En fin d’interventions plus souvent réussies (95 vs 91 % avec implantation d’au moins un clip), moins souvent compliquées (9 vs 15 %) et ayant permis plus souvent l’implantation d’au moins deux clips (64 vs 54 %), la réduction de la fuite mitrale était rapportée plus importante que dans MITRA.FR (82 % de grade ≤ 1+ vs 76 %) et plus durable (95 % de fuites grade ≤ 2+ à un an vs 80 %).
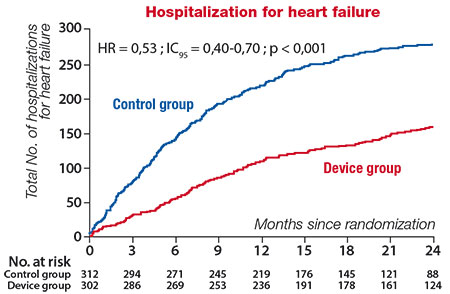
Deux ans après l’intervention, le taux d’hospitalisation pour insuffisance cardiaque était significativement réduit comparativement au bras médical (36 vs 68 pour 100 patients-années), et la mortalité, critère de jugement secondaire, significativement moindre (29 vs 46 %) (figures 3 et 4). Par ailleurs était noté une amélioration fonctionnelle et de la qualité de vie significative.
Figure 3. Survenue du critère de jugement principal (taux d’hospitalisation pour insuffisance cardiaque à 2 ans) dans l’étude COAPT.
Figure 4. Survie à 2 ans dans l’étude COAPT.
Dans une tentative d’unification des résultats, non pas discordants mais complémentaires, de ces études, est né le concept d’IM « proportionnée », définie par une régurgitation expliquée par la seule dilatation VG, dont la sévérité ne reflèterait alors que la gravité de la cardiopathie sous-jacente. Les IM « dysproportionnées », résultant d’un défaut de coaptation valvulaire non expliqué par la dilatation VG, seraient impliquées dans l’aggravation de la fonction VG et donc une cible d’interventions thérapeutiques. [32] Ainsi, une part des patients inclus dans MITRA-FR auraient une IM « proportionnée », ce qui expliquerait l’absence d’impact pronostique d’un traitement ciblant la valve mitrale chez eux.
La question de la quantification échographique de l’IM a également été soulevée, certains suggérant une approche quantitative exclusive par la fraction de régurgitation, avec un seuil de sévérité > 50 %, tandis que le volume régurgité pourrait témoigner d’effet variable de la régurgitation selon les volumes télé-diastoliques ventriculaires ou la fraction d’éjection. [33]
Le mérite de ces études, comme annoncé dans l’article précédent, est aussi de poursuivre la réflexion quant à la place de la chirurgie dans l’IM secondaire. La publication récente par une équipe allemande de l’analyse rétrospective de 132 patients présentant une IM secondaire sévère et une FEVG ≤ 30 %, ayant bénéficié dans leur centre d’une correction percutanée par MitraClip ou d’une chirurgie mitrale (le plus souvent associée à un autre geste : pontage coronaire, valvuloplastie tricuspide), confirme une surmortalité péri-opératoire de la chirurgie, mais retrouve des taux de réhospitalisation et de mortalité plus élevés à 3 ans dans le groupe MitraClip. [34]
L’explication de ce second résultat est probablement la résultante d’une plus grande gravité initiale des patients traités par voie percutanée, jugés à haut risque chirurgical, d’une moindre réduction de la fuite mitrale avec le MitraClip – la fuite résiduelle étant indépendamment associée à la mortalité et à la récidive d’insuffisance cardiaque –, ainsi qu’au bénéfice d’une revascularisation coronaire et/ou d’une correction de la fuite tricuspide contemporaine du geste chirurgical mitral.
Cette étude corrobore l’idée déjà évoquée que le traitement par MitraClip devrait viser une réduction la plus importante possible de la fuite mitrale sans se contenter d’un gain de deux grades. [35] Elle suggère par ailleurs indirectement que le traitement percutané combiné mitral et tricuspide pourrait à l’avenir améliorer le pronostic des patients présentant une IM sévère associée à une fuite tricuspide, comme cela a été rapportée par une analyse comparative des registres TriValve et TRAMI, [36] et en accord avec l’impact pronostique défavorable démontré d’une insuffisance tricuspide souvent associée à l’insuffisance mitrale. [37]
Actuellement le dispositif MitraClip peut être utilisé dans l’IM secondaire suite à l’avis favorable émis en novembre 2019 par la HAS, chez les patients avec IM secondaire de grade 3+/4+, symptomatiques malgré une prise en charge médicale optimale, non éligibles à une chirurgie, ayant été hospitalisé pour insuffisance cardiaque dans les 12 mois précédents, avec FEVG entre 20 et 50 %, SOR > 30 mm2 et VTDVG ≤ 96 mL/m2.
Références bibliographiques
[1] Nkomo VT, Gardin JM, Skelton TN, Gottdiener JS, Scott CG, Enriquez-Sarano M. Burden of valvular heart diseases: a population-based study. Lancet. 2006;368(9540):1005-11.
[2] Ling LH, Enriquez-Sarano M, Seward JB, et al. Clinical outcome of mitral regurgitation due to flail leaflet. N Engl J Med. 1996;335(19):1417-23.
[3] Mirabel M, Iung B, Baron G, et al. What are the characteristics of patients with severe, symptomatic, mitral regurgitation who are denied surgery? Eur Heart J. 2007;28(11):1358-65.
[4] Goel SS, Bajaj N, Aggarwal B, et al. Prevalence and outcomes of unoperated patients with severe symptomatic mitral regurgitation and heart failure: comprehensive analysis to determine the potential role of MitraClip for this unmet need. J Am Coll Cardiol. 2014;63(2):185-6.
[5] Moss RR, Humphries KH, Gao M, et al. Outcome of mitral valve repair or replacement: a comparison by propensity score analysis. Circulation. 2003;108 Suppl 1:II90-7.
[6] Alfieri O, Maisano F, De Bonis M, et al. The double-orifice technique in mitral valve repair: a simple solution for complex problems. J Thorac Cardiovasc Surg. 2001;122(4):674-81.
[7] Maisano F, Viganò G, Blasio A, Colombo A, Calabrese C, Alfieri O. Surgical isolated edge-to-edge mitral valve repair without annuloplasty: clinical proof of the principle for an endovascular approach. EuroIntervention. 2006;2(2):181-6.
[8] Agricola E, Maisano F, Oppizzi M, et al. Mitral valve reserve in double-orifice technique: an exercise echocardiographic study. J Heart Valve Dis. 2002;11(5):637-43.
[9] De Bonis M, Lapenna E, La Canna G, et al. Mitral valve repair for functional mitral regurgitation in end-stage dilated cardiomyopathy: role of the “edge-to-edge” technique. Circulation. 2005;112(9 Suppl):I402-8.
[10] Maisano F, Torracca L, Oppizzi M, et al. The edge-to-edge technique: a simplified method to correct mitral insufficiency. Eur J Cardiothorac Surg. 1998;13(3):240-6.
[11] St Goar FG, Fann JI, Komtebedde J, et al. Endovascular edge-to-edge mitral valve repair: short-term results in a porcine model. Circulation. 2003;108(16):1990-3.
[12] Feldman T, Wasserman HS, Herrmann HC, et al. Percutaneous mitral valve repair using the edge-to-edge technique: six-month results of the EVEREST Phase I Clinical Trial. J Am Coll Cardiol. 2005;46(11):2134-40.
[13] Feldman T, Foster E, Glower DD, et al. Percutaneous repair or surgery for mitral regurgitation [published correction appears in N Engl J Med. 2011 Jul 14;365(2):189. Glower, Donald G [corrected to Glower, Donald D]]. N Engl J Med. 2011;364(15):1395-406.
[14] Franzen O, Baldus S, Rudolph V, et al. Acute outcomes of MitraClip therapy for mitral regurgitation in high-surgical-risk patients: emphasis on adverse valve morphology and severe left ventricular dysfunction. Eur Heart J. 2010;31(11):1373-81.
[15] Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC); European Association for Cardio-Thoracic Surgery (EACTS), Vahanian A, et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J. 2012;33(19):2451-96.
[16] Taramasso M, Gaemperli O, Maisano F. Treatment of degenerative mitral regurgitation in elderly patients. Nat Rev Cardiol. 2015;12(3):177-83.
[17] O’Brien SM, Shahian DM, Filardo G, et al. The Society of Thoracic Surgeons 2008 cardiac surgery risk models: part 2–isolated valve surgery. Ann Thorac Surg. 2009;88(1 Suppl):S23-S42.
[18] Glower DD, Kar S, Trento A, et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients: results of the EVEREST II study. J Am Coll Cardiol. 2014;64(2):172-81.
[19] Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. J Am Coll Cardiol. 2013;62(12):1052-61.
[20] Lim DS, Reynolds MR, Feldman T, et al. Improved functional status and quality of life in prohibitive surgical risk patients with degenerative mitral regurgitation after transcatheter mitral valve repair. J Am Coll Cardiol. 2014;64(2):182-92.
[21] Chhatriwalla AK, Vemulapalli S, Holmes DR Jr, et al. Institutional Experience With Transcatheter Mitral Valve Repair and Clinical Outcomes: Insights From the TVT Registry. JACC Cardiovasc Interv. 2019;12(14):1342-52.
[22] Stone GW, Adams DH, Abraham WT, et al. Clinical Trial Design Principles and Endpoint Definitions for Transcatheter Mitral Valve Repair and Replacement: Part 2: Endpoint Definitions: A Consensus Document From the Mitral Valve Academic Research Consortium. J Am Coll Cardiol. 2015;66(3):308-21.
[23] Gammie JS, Sheng S, Griffith BP, et al. Trends in mitral valve surgery in the United States: results from the Society of Thoracic Surgeons Adult Cardiac Surgery Database. Ann Thorac Surg. 2009;87(5):1431-9.
[24] Mihaljevic T, Lam BK, Rajeswaran J, et al. Impact of mitral valve annuloplasty combined with revascularization in patients with functional ischemic mitral regurgitation. J Am Coll Cardiol. 2007;49(22):2191-201.
[25] Ailawadi G, Lim DS, Mack MJ, et al. One-Year Outcomes After MitraClip for Functional Mitral Regurgitation. Circulation. 2019;139(1):37-47.
[26] Kang DH, Park SJ, Shin SH, et al. Angiotensin Receptor Neprilysin Inhibitor for Functional Mitral Regurgitation. Circulation. 2019;139(11):1354-65.
[27] Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. N Engl J Med. 2018;379(24):2297-306.
[28] Tigges E, Blankenberg S, von Bardeleben RS, et al. Implication of pulmonary hypertension in patients undergoing MitraClip therapy: results from the German transcatheter mitral valve interventions (TRAMI) registry. Eur J Heart Fail. 2018;20(3):585-94.
[29] Bonow RO, O’Gara PT, Adams DH, et al. 2020 Focused Update of the 2017 ACC Expert Consensus Decision Pathway on the Management of Mitral Regurgitation: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2020;75(17):2236-70.
[30] Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med. 2018;379(24):2307-18.
[31] Enriquez-Sarano M, Michelena HI, Grigioni F. Treatment of Functional Mitral Regurgitation. Circulation. 2019;139(20):2289-91.
[32] Grayburn PA, Sannino A, Packer M. Proportionate and Disproportionate Functional Mitral Regurgitation: A New Conceptual Framework That Reconciles the Results of the MITRA-FR and COAPT Trials. JACC Cardiovasc Imaging. 2019;12(2):353-62.
[33] Hagendorff A, Doenst T, Falk V. Echocardiographic assessment of functional mitral regurgitation: opening Pandora’s box?. ESC Heart Fail. 2019;6(4):678-85.
[34] Gyoten T, Schenk S, Rochor K, et al. Outcome comparison of mitral valve surgery and MitraClip therapy in patients with severely reduced left ventricular dysfunction [published online ahead of print, 2020 May 23]. ESC Heart Fail. 2020;10.1002/ehf2.12741.
[35] Buzzatti N, De Bonis M, Denti P, et al. What is a “good” result after transcatheter mitral repair? Impact of 2+ residual mitral regurgitation. J Thorac Cardiovasc Surg. 2016;151(1):88-96.
[36] Mehr M, Karam N, Taramasso M, et al. Combined Tricuspid and Mitral Versus Isolated Mitral Valve Repair for Severe MR and TR: An Analysis From the TriValve and TRAMI Registries. JACC Cardiovasc Interv. 2020;13(5):543-50.
[37] Benfari G, Antoine C, Miller WL, et al. Excess Mortality Associated With Functional Tricuspid Regurgitation Complicating Heart Failure With Reduced Ejection Fraction. Circulation. 2019;140(3):196-206.
Guillaume Bonnet. Marseille
I. Sélection des patients
La sélection des patients présentant une IM au moins modérée à sévère (grade 3+ ou 4+), symptomatique, doit être multidisciplinaire. Elle comprend les avis d’un cardiologue spécialisé dans les maladies valvulaires et l’imagerie cardiaque, dont celui qui guidera l’intervention au bloc, du cardiologue interventionnel pratiquant l’intervention, d’un chirurgien cardiaque et d’un anesthésiste qui confirment la contre-indication chirurgicale. Le cas échéant, les points de vue d’un gériatre ou d’un autre spécialiste peuvent être requis (gastro-entérologue pour vérifier la possibilité d’une ETO prolongée en cas de pathologie oeso-gastrique par exemple). Chez les patients âgés d’évaluation fonctionnelle parfois délicate, la consultation de la famille et la réalisation d’un test de marche de 6 min s’avèrent souvent utiles.
En amont de l’analyse du mécanisme de la fuite mitrale et des caractéristiques de l’appareil valvulaire, il convient de s’assurer de la faisabilité d’un abord veineux fémoral droit (des expériences anecdotiques par abord au Scarpa gauche ou en veine jugulaire droite ont été rapportées mais ne sont pas recommandées), ainsi que de l’absence d’obstacle sur le chemin menant à l’oreillette gauche :
• sur le trajet veineux (filtre cave par exemple, ne représentant pas pour autant dans notre expérience une contre-indication, ou bien tortuosités de l’axe veineux prévisibles en cas de cyphoscoliose marquée) ;
• au sein de l’oreillette droite (thrombus ou végétation à rechercher lors de l’échographie pré-opératoire) ;
• au niveau du septum inter-atrial, parfois de franchissement difficile mais exceptionnellement cause de non indication de l’intervention, où le point de ponction dans la fosse ovale est virtuellement projeté afin de calculer une distance suffisante de ce point à l’anneau mitral, dénommée hauteur de ponction transseptale, mesurée en ETO dans une coupe 4 cavités (~ 0°), idéalement entre 40 et 45 mm.
L’ETO est indispensable pour décider de la faisabilité technique d’une intervention par MitraClip™. Hormis peut-être pour les calcifications annulaires et bien entendu la fonction VG qui seront analysées en ETT, la plupart des informations nécessaires à l’indication de l’intervention sont obtenues en ETO, à commencer par la possibilité d’un guidage de qualité en décubitus dorsal. L’aspect des feuillets, leur épaisseur, leur souplesse et la longueur de leur portion mobile, sont décrites, ainsi que la présence de calcifications annulaires ou de la base des feuillets. L’attention se porte ensuite sur le(s) jet(s) de régurgitation, dont le(s) mécanisme(s) est(sont) précisé(s). En cas de prolapsus valvulaire, sa largueur (sur un plan inter-commmissural) et sa profondeur (recul du bord libre du feuillet prolabant par rapport au plan de l’anneau) seront mesurées, tandis que dans les IM secondaires, le plus souvent restrictives, ce seront la hauteur (étendue d’accolement des deux feuillets) et la profondeur (par rapport au plan de l’anneau) de coaptation qui seront renseignées.
Les critères échographiques de l’étude princeps EVEREST définissent les cas les plus accessibles à la technique du MitraClip™ et ceux recommandés en début d’expérience. Une coaptation d’au moins 2 mm et un tenting peu marqué (moins de 11 mm de profondeur) étaient requis dans les IM secondaires, tandis qu’un prolapsus, de P2 ou A2, devait ne pas excéder 15 mm de largeur et 10 mm de profondeur. Par ailleurs, les feuillets devaient être souples, de longueur mobile de plus de 10 mm, sans calcification décelée, et la surface valvulaire mitrale de plus de 4 cm2.
L’amélioration du dispositif et l’expérience acquise autorisent le traitement de cas ne répondant pas à ces critères (tableau 1). [1] En particulier l’arrivée du modèle de clip XTR, à bras plus longs, pouvant saisir jusqu’à 12 mm de feuillet, a apporté un gain dans le traitement des valves myxoïdes avec longueur excessive de feuillet. La quatrième génération du dispositif, disponible aux États-Unis depuis fin 2019 et prochainement en France, amenant deux nouveaux modèles plus larges, offrira une possibilité de grasping indépendant de chaque feuillet, fonctionnalité qui sera probablement utile dans les cas de prolapsus très profonds avec mobilité excessive du feuillet.
Tableau 1. Caractéristiques échocardiographiques d’éligibilité à une procédure MitraClip.
Certaines manœuvres sont déjà utilisées dans les cas difficiles et expliquent pourquoi il ne faut pas les récuser à priori. Une augmentation de la pression expiratoire positive (PEP) en cours de procédure, de valeurs usuelles de 3 mmHg, à 10 voire 20 mmHg, permet d’améliorer la coaptation mitrale par réduction des diamètres ventriculaires et de l’anneau mitral. [2] Cette aide, souvent possible en l’absence d’emphysème pulmonaire sévère, est particulièrement utile dans les cas d’IM fonctionnelles ischémiques par restriction du feuillet postérieur lorsque la coaptation est faible voire en présence d’un diastasis.
L’induction d’une asystolie brève par injection d’adénosine est un autre moyen permettant de faciliter le grasping, plus utilisé dans les cas de prolapsus. La connaissance précise du matériel et des techniques utilisées justifie que la sélection des patients ait lieu lors des réunions multidisciplinaires suscitées, et en particulier que les patients ne soient pas récusés à tort en amont.
II. Déroulement de la procédure
Une intervention se déroule en salle de cathétérisme traditionnelle ou en salle hybride, sous anesthésie générale avec intubation oro-trachéale et guidée par une ETO. Quelques études ont démontré la faisabilité d’une sédation profonde mais il ne s’agit pas d’une pratique habituelle. Une anticoagulation par héparine avec un objectif d’ACT > 250 sec est indispensable afin de prévenir le risque de thrombose de cathéter. Dans notre centre, un bolus de 100 UI/kg est désormais administré d’emblée après ponction veineuse, mais il est courant d’attendre la ponction transseptale pour compléter l’héparinisation.
L’intervention peut être décomposée en six étapes
1/ Accès à l’oreillette gauche
Après ponction veineuse fémorale droite, un cathéter et une aiguille métallique sont amenés dans l’oreillette droite au contact du septum. Le point de ponction septale au sein de la fosse ovale, repéré par ETO en coupes bicave (~ 120°) et petit axe sur la valve aortique (~ 45°) doit être, respectivement sur ces plans, supérieur et postérieur, afin de se tenir à une distance de 40-45 mm de l’anneau mitral, permettant ainsi une amplitude de mouvement adéquate du cathéter porteur du clip, l’ouverture du clip dans le VG et éventuellement son retrait en inversion dans l’OG (figure 1).
Figure 1. Hauteur de ponction transseptale idéalement située entre 40 et 45 mm de l’anneau mitral.
2/ Introduction du dispositif dans l’OG
Le dispositif MitraClip™ actuel, de troisième génération, est composé d’un cathéter guide orientable de 24F (22F à son extrémité franchissant le septum) et d’un système de délivrance du clip, comprenant lui-même un manchon orientable et un cathéter de délivrance portant le clip lui-même (figure 2). Les bras du clip peuvent être ouverts, fermés, inversés, orientés par rotation en regard de la ligne de coaptation mitrale. Le clip peut aussi être déplacé vers la commissure postéro-interne (médiale), la commissure antéro-externe (latérale), en antérieur ou en postérieur. Ces fonctionnalités résultent de manipulations de boutons rotatifs situés sur la poignée du cathéter guide et celle du système de délivrance du clip.
Figure 2. Dispositif MitraClip™.
Après retrait de l’aiguille métallique de ponction transseptale, un fil-guide rigide est introduit dans l’oreillette gauche puis le cathéter de ponction est remplacé par le cathéter guide orientable qui franchit délicatement le septum et est poussé 2-3 cm plus loin dans l’OG. Le fil-guide est ensuite retiré et remplacé par le système de délivrance du clip. Celui-ci est courbé vers la valve mitrale pour lui faire face. L’ETO s’assure lors de cette manipulation que le clip ne heurte pas une paroi ou l’éperon séparant l’auricule de la veine pulmonaire supérieure gauche.
3/ Positionnement du clip dans l’OG
Le positionnement envisagé du clip doit être déterminé et obtenu dans l’OG, avant franchissement de la valve, afin de limiter toute manipulation dans le VG qui pourrait léser l’appareil sous-valvulaire mitral. Le clip doit être situé en regard du segment valvulaire à traiter sur la ligne courbe de coaptation mitrale, perpendiculairement à celle-ci (figure 3), et sur un axe relativement perpendiculaire au plan de l’anneau dirigé vers l’apex du VG. Afin de parvenir à cette position, diverses manipulations sont exercées sur le système tandis que l’échographiste alterne entre vue bicommissurale (~ 60°), vue long-axe (~ 120°) et vue 3D en face.
Figure 3. Perpendicularité du clip par rapport à la ligne de coaptation mitrale en vue ”en face“ en ETO 3D.
4/ Franchissement de la valve et grasping
Le clip est poussé dans le VG en s’assurant sur les images échographiques et de fluoroscopie que le déplacement suit l’axe précédemment décrit. Il est ensuite retiré bras ouverts jusqu’à ce que les feuillets se soient posés dessus. L’absence de déviation par rapport à la position envisagée est vérifiée. Les grippers sont alors abaissés sur le versant atrial des feuillets puis le clip partiellement fermé.
5/ Évaluation de la fuite résiduelle et largage du clip
Si sa position et son effet sont jugés adéquats, le clip est complètement fermé puis largué (figure 4). La persistance d’une régurgitation significative de part et d’autre du clip peut justifier sa réouverture et son déplacement médial ou latéral afin de ne laisser une fuite significative que d’un côté, qui sera traitée par implantation d’un ou plusieurs clips supplémentaires (figure 5). La décision d’implantation de plusieurs clips tient compte du risque de sténose valvulaire induite, apprécié par la mesure du gradient transvalvulaire moyen.
Figure 4. Valve à double orifice après implantation d’un clip.
Figure 5. Vue fluoroscopique d’implantation d’un second clip latérale au premier.
6/ Retrait des cathéters et suture cutanée
Une fois le(s) clip(s) largué(s), le système de délivrance du clip est retiré. Le cathéter guide orientable toujours en place permet une mesure des pressions atriales gauches apportant une appréciation hémodynamique du résultat obtenu (figure 6). Il est ensuite retiré dans l’oreillette droite puis, en l’absence de lésion induite du septum inter-atrial qui indiquerait sa fermeture, de la veine fémorale, dont l’hémostase est faite par simple compression.
Figure 6. Normalisation des pressions atriales gauches après implantation d’un clip.
Le succès de la procédure est défini suivant les critères MVARC comme la réduction d’au moins un grade de la fuite mitrale, qui doit être modérée tout au plus (grade ≤ 2+), sans sténose valvulaire significative induite (surface ≥ 1,5 cm2 et Gm < 5 mmHg).
Les complications, estimées à 12 % dans le registre nord-américain et dominées par le recours à la transfusion (9 %), sont en cours de procédure le plus souvent liées à l’abord veineux et à la ponction transseptale (hémorragie, tamponnade péricardique, communication inter-atriale requérant fermeture).[3] Celles en lien direct avec le dispositif MitraClip™ (détachement partiel ou complet de clip, embolisation) représentent moins de 5 % de l’ensemble des complications péri-procédurales.
Au terme de la procédure, les patients sont extubés sur table et surveillés en salle de réveil ou en Unité de Soins Intensifs. Un contrôle en ETT, qui révèle parfois une légère majoration de la fuite en état vigile, [4] est pratiqué avant la sortie d’hospitalisation, qui se fait le plus souvent directement vers le domicile 48h après l’intervention.
III. Advenue du clip et surveillance des patients
Des études anatomopathologiques des modèles porcins ayant servi à l’expérimentation initiale du dispositif ont révélé une couverture tissulaire de toutes les surfaces du clip dès 4 semaines après implantation. [5] Après 24 semaines un pont tissulaire continu reliait les deux bras du clip sur le versant atrial exposé au flux sanguin, connectant les feuillets antérieur et postérieur. Un délai de 48 semaines est attendu pour obtenir cette couverture chez l’homme. Aucun thrombus n’était décelé quel que soit le délai d’euthanasie du cochon de 4 à 52 semaines.
Malgré ce, de manière empirique suivant le protocole d’EVEREST II, une bithérapie antiplaquettaire par Aspirine et Clopidogrel est conseillée pendant 1 mois, suivie d’une monothérapie par aspirine jusqu’à 6 mois. Dans notre pratique, cela n’est pas toujours appliqué chez des patients souvent sous anticoagulant oral pour une Fibrillation Atriale.
L’incidence de survenue retardée de sténose valvulaire a également été évaluée dans l’étude porcine. La formation de pannus bourgeonnant d’un anneau chirurgical ou de la valve mitrale elle-même dans les IM secondaires, pourrait en effet faire craindre ce risque par un mécanisme analogue après implantation d’un clip. Aucune réduction notable de la surface valvulaire après couverture tissulaire du clip n’était toutefois retrouvée dans le modèle expérimental.
À ce propos, il est intéressant d’évoquer le débat sur le degré de sténose valvulaire tolérable en cas d’implantation de plusieurs clips dans le but de diminuer la fuite résiduelle. En effet, alors qu’une fuite résiduelle modérée est considérée comme un résultat « acceptable », le pronostic de ces patients semble moins favorable que ceux dont la fuite résiduelle est minime.
Ainsi, l’analyse de 223 patients consécutifs ayant bénéficié par les soins de l’équipe du Pr Alfieri d’un traitement percutané par MitraClip™ entre 2008 et 2014, pour IM primaire dans 1/3 des cas, montre une amélioration fonctionnelle moindre, un risque de récidive d’IM grade ≥ 3+ et une mortalité accrus à 2 ans en cas de fuite résiduelle de grade 2+. [6]
Réciproquement, une étude parue en 2017 reliait un gradient de pression trans-valvulaire moyen hémodynamique > 5 mmHg (correspondant à un seuil de 4,4 mmHg en échographie) à une surmortalité, faisant proscrire l’implantation d’un clip supplémentaire quel que soit le degré de fuite résiduelle en cas d’atteinte de ce seuil pendant la procédure. [7]
Une étude récente d’effectif comparable (255 patients), comprenant une légère majorité d’IM secondaires (59,2 %), a retrouvé ce lien statistiquement significatif dans les cas d’IM primaires, tandis qu’un gradient > 4,4 mmHg (5,5 mmHg en moyenne) après traitement d’IM secondaires ne prédisait pas un risque plus élevé de survenue d’événements majeurs au cours d’un suivi moyen de 20 mois. [8] Un objectif de réduction maximale de l’IM pourrait prévaloir dans les formes secondaires en autorisant des gradients plus élevés, sans toutefois excéder 10 mmHg si l’on prend en compte les résultats d’une autre étude aux mêmes conclusions. [9]
Ceci serait cohérent avec les travaux plus anciens de la Mayo Clinic démontrant une relation continue entre le degré de fuite mitrale et le pronostic de l’IM ischémique. [10] D’autres études seront nécessaires pour préciser cet aspect important dans la prise de décision en cours d’intervention.
En France, chaque patient devrait être inclus dans le registre national MITRAGISTER, dans lequel sont renseignées des informations cliniques, échographiques, procédurales et de suivi à 6 mois, 1 an et 2 ans. Ce registre apportera certainement des données intéressantes sur les indications retenues en vie réelle dans notre pays et sur le devenir des patients. Peu de données portant sur le suivi à plus long terme des patients sont disponibles. L’essai EVEREST II a été mené jusqu’à 5 ans de suivi. [11]
À ce terme, le critère de jugement composite associant absence de mortalité, d’intervention chirurgicale et d’IM grade 3+ ou 4+, était retrouvé, en analyse per-protocole, chez 44 % des patients du bras MitraClip™ vs 64 % dans le bras chirurgie. Cette différence significative était expliquée par les taux plus élevés d’IM grade 3+ ou 4+ (12,4 % vs 1,8 %) et de nécessité de chirurgie (27,9 % vs 8,9 %) dans le bras MitraClip™ alors que la mortalité était moindre après MitraClip™ (20,8 % vs 26,8 %) mais sans corrélation significative en analyse multivariée entre stratégie thérapeutique et survie. Après MitraClip™, 78 % des chirurgies de reprise avaient lieu dans la période de 6 mois qui suivait.
Au-delà, aucune différence significative n’était notée quant aux taux de chirurgie et d’IM grade 3+ ou 4+ entre les deux groupes. L’analyse des patients n’ayant pas présenté d’événement la première année montrait entre 1 et 5 ans des taux de réintervention bas, similaires dans les deux groupes (5,7 % après MitraClip™ vs 6,3 %), et une amélioration symptomatique persistante, faisant conclure à une durabilité à 5 ans du succès d’une intervention quelle que soit la technique employée.
Autre fait notable, malgré le taux plus élevé de fuites résiduelles modérées et l’absence d’annuloplastie dans le bras MitraClip™, la réduction des paramètres de dimension VG constatée à un an était maintenue à 5 ans, sans dilatation annulaire par ailleurs, semblant objecter l’hypothèse qu’une réduction moins efficace de la fuite résulterait au fil du temps en une dilatation progressive du VG dont découlerait à plus long terme une surmortalité.
Un essai qui serait conduit actuellement, avec une sélection affinée des patients et une expérience accrue des opérateurs, amplifierait probablement les bénéfices de la technique percutanée, mais ces données permettent déjà de ne pas douter qu’une intervention par MitraClip™ puisse être bénéfique chez de nombreux patients, sous réserve d’une sélection rigoureuse et de résultats optimaux.
De là à faire du clip mitral percutané un concurrent actuel de la plastie mitrale chirurgicale du sujet jeune asymptomatique avec IM primaire sévère, la route reste encore longue comme écrit dans le premier article, mais ouverte…
IV. Conclusion
Le MitraClip™ est le premier dispositif de réparation valvulaire mitrale percutanée ayant obtenu le marquage CE et s’est imposé, avec près de 100 000 procédures à son actif dans le monde, comme un traitement sûr et souvent efficace de l’insuffisance mitrale, entre les mains d’opérateurs consacrés à cette technique, chez des patients sélectionnés ne pouvant bénéficier d’une chirurgie. En réduisant significativement la fuite mitrale, il est à l’origine d’une amélioration de la qualité de vie des patients, de leur statut fonctionnel, voire d’un allongement de leur survie dans certains cas d’IM secondaires en comparaison au traitement médical.
Le perfectionnement de la technique est croissant, concernant aussi bien l’amélioration technologique du dispositif, que la maîtrise de l’abord transseptal, les mesures affinant la précision du geste, la coordination du binôme interventionnel-échographiste ou encore l’évaluation en temps réel de la fuite résiduelle. Les meilleurs résultats sont obtenus dans les situations anatomiques optimales, qui pourrait faire considérer à l’avenir son indication en première intention chez des patients non formellement contre-indiqués à une circulation extra-corporelle. Ceci d’autant qu’un résultat non satisfaisant au terme d’une intervention le plus souvent très bien tolérée, n’obère pas un geste chirurgical secondaire, y compris de réparation.
À la suite du MitraClip™ s’annoncent d’autres dispositifs de réparation valvulaire mitrale percutanée (bord à bord, annuloplastie) et de remplacement valvulaire par voies transapicale ou transseptale. Dans l’attente de leur expérimentation ou généralisation, le MitraClip™ se pose en technique accessible pouvant bénéficier à de nombreux patients. La méconnaissance de ce bénéfice potentiel fait parfois préférer à tort un traitement médicamenteux chez des patients jugés fragiles. Et pourtant, à condition de sélectionner les bons candidats après évaluation par une équipe ayant acquis une expertise de la technique, comme annoncé dans l’éditorial, souvent en effet « ça marche »…
Références bibliographiques
[1] Hahn RT. Transcathether Valve Replacement and Valve Repair: Review of Procedures and Intraprocedural Echocardiographic Imaging. Circ Res. 2016;119(2):341-56.
[2] Patzelt J, Zhang Y, Seizer P, et al. Effects of Mechanical Ventilation on Heart Geometry and Mitral Valve Leaflet Coaptation During Percutaneous Edge-to-Edge Mitral Valve Repair. JACC Cardiovasc Interv. 2016;9(2):151-9.
[3] Chhatriwalla AK, Vemulapalli S, Holmes DR Jr, et al. Institutional Experience With Transcatheter Mitral Valve Repair and Clinical Outcomes: Insights From the TVT Registry. JACC Cardiovasc Interv. 2019;12(14):1342-52.
[4] Geis NA, Puls M, Lubos E, et al. Safety and efficacy of MitraClip™™ therapy in patients with severely impaired left ventricular ejection fraction: results from the German transcatheter mitral valve interventions (TRAMI) registry. Eur J Heart Fail. 2018;20(3):598-608.
[5] Fann JI, St Goar FG, Komtebedde J, et al. Beating heart catheter-based edge-to-edge mitral valve procedure in a porcine model: efficacy and healing response. Circulation. 2004;110(8):988-93.
[6] Buzzatti N, De Bonis M, Denti P, et al. What is a “good” result after transcatheter mitral repair? Impact of 2+ residual mitral regurgitation. J Thorac Cardiovasc Surg. 2016;151(1):88-96.
[7] Neuss M, Schau T, Isotani A, Pilz M, Schöpp M, Butter C. Elevated Mitral Valve Pressure Gradient After MitraClip™ Implantation Deteriorates Long-Term Outcome in Patients With Severe Mitral Regurgitation and Severe Heart Failure. JACC Cardiovasc Interv. 2017;10(9):931-9.
[8] Patzelt J, Zhang W, Sauter R, et al. Elevated Mitral Valve Pressure Gradient Is Predictive of Long-Term Outcome After Percutaneous Edge-to-Edge Mitral Valve Repair in Patients With Degenerative Mitral Regurgitation ( MR ), But Not in Functional MR. J Am Heart Assoc. 2019;8(13):e011366.
[9] Cheng R, Dawkins S, Tat E, et al. Relation of Residual Mitral Regurgitation Despite Elevated Mitral Gradients to Risk of Heart Failure Hospitalization After MitraClip™ Repair. Am J Cardiol. 2017;120(9):1595-600.
[10] Grigioni F, Enriquez-Sarano M, Zehr KJ, Bailey KR, Tajik AJ. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation. 2001;103(13):1759-64.
[11] Feldman T, Kar S, Elmariah S, et al. Randomized Comparison of Percutaneous Repair and Surgery for Mitral Regurgitation: 5-Year Results of EVEREST II. J Am Coll Cardiol. 2015;66(25):2844-54.

Copyright © 2024 | MH Magazine WordPress Theme by MH Themes